(14分)FeCl3在选修四中出现的次数较多,可见其重要性.
(1)在演示催化剂对化学反应速率的影响实验中,向H2O2溶液中分别滴入FeCl3溶液和CuSO4溶液,催化效果更好的是________ (1分),画出无催化剂和有催化剂的能量-反应进程对比图,并作必要的文字注明(3分)
(2)在演示增加反应物浓度对化学平衡的影响实验中,稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。将该浅血红色分成两等份,分别加入同浓度的FeCl3溶液和稀KSCN溶液,红色变得更深的是________(1分), 从化学平衡常数的角度加以分析(3分)(温度不变,假设后加入的FeCl3溶液和稀KSCN溶液都是各自起始浓度的10倍)(3分)
(3)分别取若干毫升稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色。限用FeCl3、KSCN、 KCl三种化学药品,为证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,至少还要进行( )次实验。
| A.1 | B.2 | C.3 | D.4 |
(4)实验室配制和保存FeCl3溶液,要向其中加入________,防止其水解变质。
(5)0.1mol·L-1 FeCl3溶液中的c(Fe3+) 比0.1mol·L-1 (NH4)Fe(SO4)2溶液中的c(Fe3+)______.
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答:
(1)写出醋酸的电离方程式_______________________________________。
(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为________________ 。
(3)a、b、c三点中醋酸的电离程度最大的是。
(4)取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲__ 10C(H+)乙(填“大于”、“小于”或 “等于”)甲,其原因是:。
⑴3.6g H2O的物质的量是________,含有_______________个水分子,含有________mol H原子。(水的相对分子质量是18)
⑵酸、碱、盐在水溶液中发生的复分解反应,实质上是,
这类离子反应发生的条件是,
只要具备上述条件之一,反应就能发生。
(10分)纯净物根据其组成和性质可进行如下分类。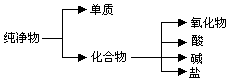
⑴上图所示的分类方法属于(填序号)
A、交叉分类法 B、树状分类法
⑵以H、O、S、C、K、Ca六种元素中任意两种或三种元素组成合适的常见物质,分别将其中一种常见物质的化学式填写于下表相应类别中:
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
⑶下列4组物质均有一种物质的类别与其他3种不同,且这四种物质相互作用可生成一种新物质——碱式碳酸铜,化学式为Cu2(OH)2CO3。
A. CaO、Na2O、CO2、CuO
B. H2、C、P、Cu
C. O2、Fe、Cu、Zn
D. HCl、H2O、H2SO4、HNO3
以上四组物质中与其他物质不同的物质依次是(填化学式)
A.________;B.________;C.________;D.________。
(6分)阅读下面两条科普信息,回答问题:
(1)一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(2)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示)。
问题:
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明亚铁离子(Fe2+)具有性,铁离子(Fe3+)具有性,
(1)中的维生素C是剂,(2)中的CO2剂,写出(2)中的离子方程式。
(6分)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:
2KNO3+3C+S===K2S+N2↑+3CO2↑。其中被还原的元素是,
被氧化的元素是,氧化剂是,
用双线桥表示出电子转移的方向和数目。(在方程式中直接标出)