工业合成有机物F路线如下: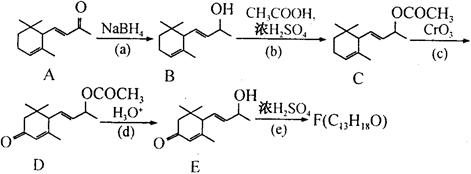
(1)有机物D中含氧的官能团名称为 和 。
(2)化合物F的结构简式是 。
(3)在上述转化关系中,设计步骤(b)和(d)的目的是 。
(4)写出步骤(d)的化学反应方程式 。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式 。
| A.属于芳香化合物 | B.核磁共振氢谱有四个峰 |
| C.1mol该物质最多可以消耗2molNaOH | D.能发生银镜反应 |
(6)已知: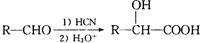 ,写出以乙醇和
,写出以乙醇和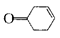 为原料制备
为原料制备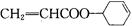 的合成路线图(无机试剂任选)。合成路线流程图示例如下:
的合成路线图(无机试剂任选)。合成路线流程图示例如下:
能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,下图是一种镍基合金储氢后的晶胞结构图。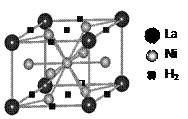
① Ni原子的价电子排布式是▲。
② 该合金储氢后,含1mol La的合金可吸附H2的数目为▲。
(2)南师大结构化学实验室合成了一种多功能材料——对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是▲。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是▲。
(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构。该阴离子的电子式是▲,其中心原子N的杂化方式是▲。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)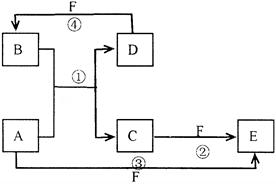
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,
则A的原子结构示意图为__________,反应④的化学方程式为④.
(2)若A为常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________,已知常温下1g D与F反应生成B(气态)时放出92.3kJ热量,写出反应的热化学方程式____________________ .
.
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________________,分子E的结构式为__________
(8分) 三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它能发生如下反应:3NF3+5H2O===2NO+HNO3+9HF。请回答下列问题:
⑴NF3中氮元素的化合价为;
⑵NF3的大于HNO3(填氧化性或还原性);
⑶在上述反应中还原剂与氧化剂的物质的量之比为;
⑷若生成0.2 mol HNO3,则转移的电子数为;
10分)写出下列反应的离子方程式
⑴电解饱和食盐水
⑵铝与氢氧化钠溶液反应
⑶碳酸氢钠溶液中滴入少量的氢氧化钙溶液
⑷加热次氯酸钠浓溶液与浓盐酸的混合液
⑸在溴化亚铁溶液中通入过量的氯气
、近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚氯乙烯(PVC)和人造羊毛的合成路线。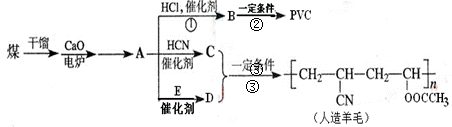
请回答下列问题:
(1)A的结构中含有三键,写出A的结构式,
写出B和PVC的结构简式
(2)写出反应类型反应①反应②。
(3)反应③中C、D两种单体按…CDCDCD…方式加聚,D的结构为CH2=CHOOCCH3,写出C的结构简式。
(4)写出D与氢氧化钠溶液共热时发生的化学反应方程式。