(14分)为测定NaOH溶液的浓度,实验如下:用标准稀盐酸溶液进行滴定
(1)配制100 mL 0.1000mol·L-1盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要
(2)用 量取20.00 mL待测NaOH溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取NaOH溶液体积均为20.00 mL,三次实验结果如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗盐酸溶液体积/mL |
19.00 |
23.00 |
23.04 |
该NaOH溶液的浓度约为____________________
(3)滴定时边滴边摇动锥形瓶,眼睛 ______
(4)下列操作会造成测定结果(待测NaOH溶液浓度值)偏低的有 _____
A. 配制标准溶液定容时,加水超过刻度 B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用标准稀盐酸溶液润洗
D. 滴定到达终点时,俯视读出滴定管读数;
E. 酸式滴定管尖嘴部分有气泡,滴定后消失
F. 摇动锥形瓶时有少量液体溅出瓶外
(5)画出滴定过程中锥形瓶内溶液的pH随滴入标准盐酸溶液体积的变化曲线
(6)中和滴定的装置和相似操作来做其它实验,如据反应I2 + 2S2O32- = 2I- +S4O62-可以用碘水滴定Na2S2O3溶液,应选_作指示剂;据反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2+2MnSO4+8H2O可以用酸性KMnO4溶液滴定H2C2O4溶液,KMnO4溶液应装在_______滴定管中。
(10分)甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:
①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L乙溶液中c(H+)>0.1mol/L;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。回答:
(1)丁溶液是
(2)乙溶液的电离方程式
(3)丙溶液PH 7, 原因用方程式表示
(4)乙和丁反应的离子方程式
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
(1)元素Z位于周期表中第_______周期,_______ 族;
(2)这些元素的氢化物中,水溶液碱性最强的是_______________(写化学式);
(3)XW2的电子式为_______________
(4)Y的最高价氧化物的水化物与其氢化物反应的离子方程式 。
(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,该烧杯的实际质量为______________g。
滴定管中的液面如下图所示,正确的读数为mL。
(2)指出下面3个实验中各存在的一个错误: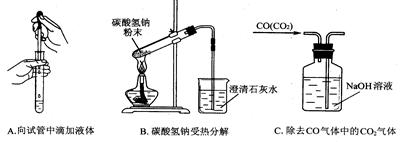
A____________________,B_____________________,C________________________
有某种含有少量FeCl2杂质的FeCl3样品。现要测定其中铁元素的质量分数,实验采用下列步骤进行:
①准确称量mg样品(在2—3g范围内):
②向样品中加入10mL 6 moL·L-1的盐酸,再加入蒸馏水,配制成250mL溶液:
③量取25mL操作②中配得的溶液,加入3mL氯水,加热使其反应完全;
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全:
⑤过滤,将沉淀洗涤后,移至坩埚,灼烧、冷却、称重,并重复操作至恒重。
试回答下列问题:
(1)溶解样品时,要加入盐酸,原因是;
(2)加入氯水后,反应的离子方程式为;
(3)加入过量氨水生成沉淀的离子方程式为;
(4)若不用氯水,可用下列试剂中的代替(填序号)。
A.H2O2 B.碘水 C.NaClO
(5)步骤⑤中检验沉淀是否洗净的方法是。
(6)若坩埚质量为W1g,坩埚及灼烧后的固体总质量为W2g,样品中铁元素的质量分数为(请把结果约到最简)。
A+B→X+Y+H2O(为配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1∶4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是,该反应的化学方程式是.
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是.
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是______(填所在周期和族);Y的化学式是______.
②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是______ mol.