(12分)恒温下,将a mol O2与bmol SO2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
O2 (g) + 2SO2(g) 2SO3(g)
2SO3(g)
(一)①若反应达平衡时,n(O2) = 4mol,n(SO3) = 4mol,计算a的值为 。
②平衡时总体积在标准状况为313.6L,原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
③达到平衡时,O2和SO2的转化率之比,α(O2)∶α (SO2)= 。
(二)若起始将6mol O2、b mol SO2和1 molSO3通入上反应容器中,起始反应向正方向进行,使反应达到平衡时容器中气体的物质的量为12mol。则b的取值范围是 。
(6分)有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3中的一种或几种,现按下列步骤进行实验。
(1)将该粉末溶于水得无色溶液和白色沉淀。
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体。
(3)取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见紫色火焰。
由上述现象推断:该混合物中一定含有;一定不含有;可能含有
(10分)现有下列几种物质:①铝②石墨③氢氧化钠④BaSO4晶体⑤H2SO4⑥CO2⑦食盐水⑧乙醇⑨熔化的KNO3 ⑩泥浆水⑾淀粉溶液⑿氧化钙,
请用编号填写下列空格:
(1) 属于电解质的是(填代号,以下同),属于非电解质的是,能导电的是。
(2)属于分散系的有 ,其中属于胶体的有 。
某些化学反应可用下式表示:A + B= C + D + H2O
请回答下列问题:
(1)若A、D均可用于消毒,且C是家家户户的厨房必备的调味品之一,写出该反应的离子方程式:。
(2)若A为水垢的主要成分之一,B是厨房日常生活常见有机物,写出该反应的化学方程式:。
(3)若A为亮红色单质,B为第二周期某种元素的最高价氧化物的水化物,A、B、C、D中只有D是气体,若D无色且在空气中容易变为红棕色气体,写出该反应的化学方程式:。
W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中Z位于ⅦA族。请回答下列问题。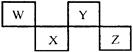
(1)请写出各对应的元素符号:W、 X、 Y、 Z。
(2)W、Y和氢3种元素所形成的一种化合物,其75%(体积分数)的溶液常用于医疗消毒,该化合物的化学式为
(3)电解NaZ水溶液时,总反应化学方程式为。工业上,以上述反应的阳极产物和Ca(OH)2为原料,制备漂白粉反应的化学方程式为。
(4)已知:元素钠与元素Y可组成原子个数比为1:1的化合物。请写出该化合物与含W的最高价氧化物发生反应的化学方程式为。
、铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子
6SO2+Fe3O4,有3 molFeS2参加反应,转移 mol电子
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;从腐蚀废液回收得到金属铜,还需要的试剂是 。
(3)、配平下列化学方程式(并解答对应问题):
KMnO4+HCl==KCl+MnCl2+Cl2↑+H2O
氧化剂还原剂