现有5种有机物:①乙烯,②乙醇,③乙醛,④乙酸,⑤乙酸乙酯。
(1)请分别写出其中含有下列官能团的有机物的结构简式
①-OH________ ②-CHO________ ③-COOH________
(2)在上述5种有机物中(填写序号)
①能发生银镜反应的是 。
②能发生水解反应的是
③具有酸性且能发生酯化反应的是
④既能发生加成反应,又能发生聚合反应的是
市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
(1)“热敷袋”放出的热量是利用铁发生了反应放出热量。
(2)炭粉的主要作用是。
(3)加入氯化钠的主要作用是。
(4)木屑的作用是。
某同学在做原电池原理的实验时,有如下实验步骤:
①用导线将灵敏电流计的两端分别与纯净的锌片和铜片相连接(如图1);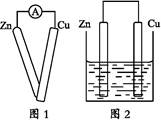
②把一块纯净的锌片插入盛有稀硫酸的烧杯中;
③把一块纯净的铜片插入盛有稀硫酸的烧杯中;
④用导线把锌片和铜片连接起来后,再平行地插入盛有稀硫酸的烧杯中(如图2)。
回答下列问题:
(1)实验步骤①中应观察到的现象是 。
(2)实验步骤②中应观察到的现象是 。
(3)实验步骤③中应观察到的现象是 。
(4)实验步骤④中应观察到的现象是 。
(5)通过实验步骤④该同学头脑中有了一个猜想(或假设),该猜想是 。
(6)为了证实该猜想,该同学又设计了第⑤步实验,请简要画出第⑤步实验的装置示意图。
已知各破坏1 mol N≡N键、H—H键和N—H键分别需要吸收的能量为946 kJ、436 kJ、391 kJ。计算1 mol N2(g)和3 mol H2(g)完全转化为NH3(g)的能量变化理论值为。
取等物质的量的MgO和Fe2O3的混合物进行铝热反应,反应的化学方程式为 ,引发铝热反应的实验操作是 。进行铝热反应时,内层纸漏斗底部剪一小孔用水润湿的目的是 。
目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 ,写出在沉淀池中发生反应的离子方程式 。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。
(3)操作A是 ,操作B是 。
(4)加入的足量试剂a是 (填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为 。从考虑成本和废物循环利用的角度,副产物氯气可以用于 。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
_____________________________________________