有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物, E的阳离子与A的阴离子核外电子层结构相同。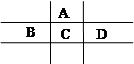
请回答下列问题:
⑴C元素在周期表中的位置为 。
⑵写出A与氢元素能形成原子物质的量之比为1∶1的化合物的结构式 ,分子中所含共价键的类型为 。
⑶比较A、C氢化物的稳定性:A C(填大于、小于或等于),原因是 。
⑷B、C、D的原子半径由大到小的顺序为(用元素符号表示) 。
⑸若将E制作成电极与石墨用导线相连,回答下列问题:
将两电极插入盛有稀H2SO4的烧杯中形成原电池,E电极为 极,写出该电池的负极的电极反应是: ;电池总反应(用离子方程式表示) 。
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: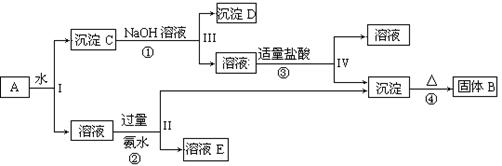
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是。
(2)根据上述框图反应关系,写出下列B、 D所含物质的化学式
固体B;沉淀D。
(3)写出①、②反应的离子方程式:
①;②;
(4)以Fe2O3为原料,可制备FeCl2溶液,请写出有关的化学反应方程式,试剂任选。
Ⅰ.小苏打是某种治疗胃酸过多的胃药的主要成分,请写出该反应的离子方程式:。
Ⅱ.氨气通入水中可制得氨水,氨水能使无色的酚酞变红。请写出实验室制取氨气的化学方程式:,
检验氨气的一种化学方法是:。
Ⅲ.火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S=K2S+2NO2↑+CO2↑。其中氧化剂是;还原剂是。
M是可降解的高分子化合物,以芳香醇A为原料合成它的路线如下。
已知:

(1)写出反应Ⅰ的反应试剂和反应条件。
(2)写出反应类型。反应Ⅱ反应Ⅲ。
(3)写出结构简式。EF。
(4)写出G→M的化学反应方程式。
(5)反应Ⅰ能否省略?;说明原因。
(6)从E→F经过两步,这两步的次序能否颠倒?;说明原因。
以石油裂解产物烯烃为原料合成一些新物质的路线如下。
已知:Diels-Alder反应为共轭双烯与含有烯键或炔键的化合物相互作用生成六元环状化合物的反应,最简单的Diels-Alder反应是
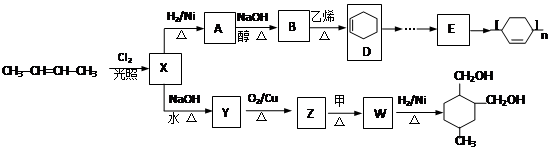
完成下列填空:
(1)写出X分子中所含官能团的名称。
(2)写出A→B的化学方程式。
(3)写出甲物质的名称。
(4)属于酯类且分子中含有两个甲基的Y的同分异构体有种。
(5)R是W的一种同分异构体,R遇FeCl3溶液显紫色,但R不能与浓溴水反应,写出R的结构简式。
(6)写出实验室由D制备E的合成路线。
(合成路线常用的表示方式为: )
)
锶(Sr)是人体必需的微量元素,其单质和化合物的化学性质与钙、钡的相似。实验室用含碳酸锶的废渣(含SrCO3 38.40%,SrO12.62%,CaCO3 38.27%,BaCO3 2.54%,其它不溶于硝酸的杂质8.17%)制备硝酸锶粗品的部分实验过程如下:
(1)市售浓硝酸的质量分数为65%,密度为1.4g/cm3,要配制30%稀硝酸500mL,还需要查阅的数据是,若配制过程中不使用天平,则必须要计算的数据是,必须要使用的仪器是。
已知两种盐的溶解度(g/100 g水)如下表
| 温度/℃物质 |
0 |
20 |
30 |
45 |
60 |
80 |
100 |
| Sr(NO3)2 |
28.2 |
40.7 |
47 |
47.2 |
48.3 |
49.2 |
50.7 |
| Ca(NO3)2·4H2O |
102 |
129 |
152 |
230 |
300 |
358 |
408 |
(2)由浸取后得到的混合物制备硝酸锶粗品的实验步骤依次为:过滤、、、洗涤,干燥。
已知,硝酸钙能溶于有机溶剂A中。式量:Sr(NO3)2–212、Ba(NO3)2–261、Ca(NO3)2–164
(3)制得的硝酸锶粗品中含少量Ca(NO3)2、Ba(NO3)2等杂质。测定硝酸锶纯度的实验如下:称取5.39g硝酸锶样品,加入足量的有机溶剂A,经过滤、洗涤、干燥后,剩余固体5.26g,将此固体配成250 mL的溶液,取出25.00 mL,调节pH为7,加入指示剂,用浓度为0.107mol/L的碳酸钠溶液滴定至终点,消耗碳酸钠溶液22.98mL。
滴定过程的反应:Sr2++CO32-→ SrCO3↓ Ba2++CO32-→ BaCO3↓
①滴定选用的指示剂为,滴定终点观察到的现象为。
②该硝酸锶粗品中,硝酸锶的质量分数为(小数点后保留两位)。若滴定前样品中Ca(NO3)2没有除尽,所测定的硝酸锶纯度将会(填“偏高”、“偏低”或“不变”)。