下列实验操作不正确的是
| A.做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 |
| B.进行分液操作时,应将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准上口颈上的小孔,打开旋塞,使下层液体从漏斗颈下慢慢流出,待下层液体完全流出后,关闭旋塞,上层液体从漏斗上口倒出 |
| C.蒸发操作中,边加热边用玻璃棒搅拌,当加热至蒸发皿中有较多固体析出时,应停止加热,利用余热将液体蒸干 |
| D.过滤操作中,滤纸边缘一定低于漏斗边缘,将玻璃棒靠在三层滤纸的边缘,将烧杯嘴靠在玻璃棒上,慢慢引流倒入液体 |
丙烷的分子结构可简写成键线式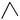 ,有机物A的键线式结构为
,有机物A的键线式结构为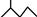 ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法不正确的是
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法不正确的是
A.用系统命名法命名有机物A,名称为2-甲基戊烷
B.有机物A的一氯取代物有4种
C.有机物A的分子式为C6H14
D.B的结构可能有4种
下列关系正确的是
| A.含氢量:苯>乙烯>甲烷 |
| B.密度:H2O >溴苯 > |
| C.沸点:戊烷>2-甲基丁烷>2,2-二甲基丙烷 |
| D.等质量的下列物质燃烧耗O2量:乙炔>乙烯>乙烷 |
下列有机物的命名中,正确的是
| A.3—甲基—1—丁烯 | B.2—乙基丁烷 |
| C.2,2—二甲基—4—丁醇 | D.2,3,3—三甲基丁烷 |
下列分子式表示的物质一定是纯净物的是
A.C2H6O B.C2H4Cl2 C.CH4O D.
设NA为阿伏加德罗常数,下列有关说法正确的是
| A.0.5 mol苯分子中含有C=C双键数为1.5 NA |
| B.1 mol甲基(—CH3)所含的电子总数为10 NA |
C.标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为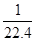 NA NA |
| D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |