反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸汽的物质的量增加了0.45mol,则此反应的平均速率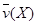 (反应物的消耗速率或产物的生成速率)可表示为
(反应物的消耗速率或产物的生成速率)可表示为
A.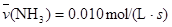 |
B.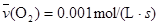 |
C.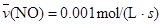 |
D.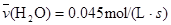 |
下列关于一定原子轨道上运动的电子的几种判断正确的是()
| A.一个原子轨道上只能有一个电子 |
| B.处在同一原子轨道上的电子运动状态完全相同 |
| C.处在同一能级中的电子(基态)能量一定相同 |
| D.处在同一电子层上的电子(基态)能量一定不同 |
右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,合这一情况的是 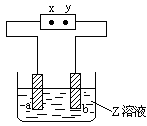
| a极板 |
b极板 |
x电极 |
Z溶液 |
|
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |
下列描述正确的是
| A.在pH=1溶液中,NH4+、K+、ClO—、Cl—可以大量共存 |
| B.MgO可以除去MgCl2溶液中的FeCl3 |
| C.足量铁粉与稀硝酸反应:Fe + 4H+ +NO3—== Fe3+ + 2H2O + NO ↑ |
D.对于平衡体系:H2(g)+I2(g)  2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深 2HI(g),其它条件不变时,增大体系压强,平衡向正反应方向移动,体系颜色加深 |
下列有关电化学知识的描述正确的是
| A.CaO+H2O="=" Ca(OH)2可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 |
| B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag装置中的盐桥中可以是装有含琼胶的KCl饱和溶液 |
| C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极 |
| D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa 固体 ⑤NaNO3溶液 ⑥KCl溶液
| A.②④⑤⑥ | B.①② | C.②③⑤ | D.②④⑥ |