某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000 mol·L—1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(6)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.40 |
| 第二次 |
20.00 |
4.00 |
29.10 |
请计算待测NaOH溶液的浓度为 mol·L—1。
已知反应:Fe(s)+CO2(g)  FeO(s)+CO(g)DH=akJ·mol-1
FeO(s)+CO(g)DH=akJ·mol-1
测得在不同温度下,该反应的平衡常数K值随温度的变化如下表所示:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)该反应的化学平衡常数表达式为 ,若在500℃2L密闭容器中进行该反应,CO2起始量为4mol,5min后达到平衡状态,则v(CO)为 。
(2)若在700℃时该反应达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有 (填序号,下同)。不能增大化学反应速率的有 。
A.缩小反应容器的体积
B.通入适量CO2
C.加入适量铁
D.升高温度到900℃
E.使用合适的催化剂
(3)下列图像符合该反应的是 (填序号)(图中v代表速率、ω代表混合物中CO的含量,T代表温度)。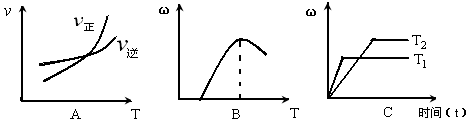
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A: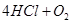
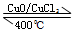
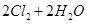
已知:i.反应A中,2mol 电子发生转移,放出57.8kJ的热量。
ii.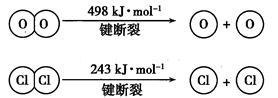
①H2O的电子式是 。
②反应A的热化学方程式是 。
③断开1mol H-O键与断开1mol H-Cl键所需能量相差 kJ,H2O中H-O键比HCl中H-Cl键 (填“强”或“弱”)
下列物质中属于强电解质的是: ,属于弱电解质的是 。
a.BaSO4
b.NaHCO3
c.H2SO3
d.Cu
e.Fe(OH)3
写出c、e两物质的电离方程式 。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。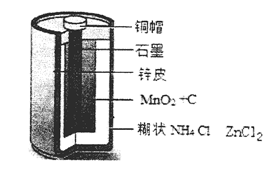
(1)该电池的负极材料是 电池工作时,电子从Zn极流向 填(“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是 。
欲除去Cu2+,最好选用下列试剂中的 (填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液制取,则MnO2在 极产生。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 g。(MnO2的摩尔质量为:87g/mol)
回答下列问题。
(1)如右图,某温度(t℃)时水的图像如下,a点离子积KW=__________mol2·L-2;该温度下,pH=12的NaOH与pH=2的H2SO4等体积混合,溶液显_________性。
(2)25℃时,向0.1mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH__________,NH+4的物质的量浓度________。(填增大、减小或不变)
(3)体积相等的稀NaOH和CH3COOH溶液混合,若溶液中c(Na+)=c(CH3COO-),则该溶液显______(填“酸性”、“碱性”、“中性”),则混合前c(NaOH)___________C(CH3COOH)(填“>”、“<”或“=”)。
(4)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5mol·L-1),则溶液的pH最小为___________。
(5)用可溶性碳酸盐,可以浸取CaSO4固体,则溶液浸取过程中会发生反应:
CaSO4(s)+CO2-3(aq)  CaCO3(s)+SO2-4(aq)。
CaCO3(s)+SO2-4(aq)。
已知298K时,KSP(CaCO3)=2.80×10-9, KSP(CaSO4)=4.90×10-5,则此温度下该反应的平衡常数K为_________(计算结果保留三位有效数字)。