 与
与 混合时存在下列平衡:
混合时存在下列平衡: 。已知平衡时,物质盼量浓度
。已知平衡时,物质盼量浓度 与温度T的关系如右图所示,则下列说法正确的是
与温度T的关系如右图所示,则下列说法正确的是
A. |
B.温度为 、 、 时,反应的平衡常数分别为 时,反应的平衡常数分别为 、 、 ,则 ,则 |
| C.反应处于D点时,一定有V(正)>V(逆) |
D.A点与B点相比,A点的 大 大 |
把3 mol M和2.5 mol N混合于2 L的密闭容器中,发生反应的化学方程式为:
3M(g) + N(g) 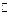 xP(g) + 2Q(g),5min后反应达到平衡,若反应前后温度不变,容器内压强变小,已知
xP(g) + 2Q(g),5min后反应达到平衡,若反应前后温度不变,容器内压强变小,已知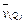 = 0.1mol·L-1·min-1,则下列说法错误的是()
= 0.1mol·L-1·min-1,则下列说法错误的是()
| A.M的平均反应速率为0.15 mol·L-1·min-1 |
| B.平衡时N的转化率为25% |
| C.平衡时P的浓度为0.25 mol·L-1 |
D.平衡时容器内的压强为原来的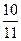 倍 倍 |
某合成氨工厂测得进入合成塔中N2和H2混合气体的平均相对分子质量为12.4,从合成塔中出来的混合气体的平均相对分子质量为15.5。求该合成氨厂N2的转化率为()
| A.25% | B.33% | C.50% | D.66.6% |
常温时,向pH = 2的硫酸溶液中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是()
| A.pH = 12的Ba(OH)2 | B.pH = 12的NH3·H2O |
C.0. 05 mol/L的NaOH 05 mol/L的NaOH |
D.0.05 mol/L的BaCl2 |
如图,abcd分别代表酸碱溶液加水稀释后pH与加水的体积的关系。下列判断正确的是()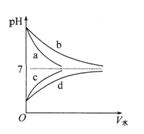
| A.a和b为强电解质 |
| B.等体积的c和d分别与足量的镁粉反应,放出H2一样多 |
| C.c和d的物质的量浓度相同 |
| D.pH相等的a和b分别加水稀释m和n倍后pH仍相等,则m < n |
下列说法或表达式正确的是()
A.CaCO3的电离方程式:CaCO3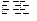 Ca2++CO32- Ca2++CO32- |
| B.物质的量浓度相同,体积也相同的一元酸和一元碱恰好中和时溶液一定呈中性 |
| C.工业上合成氨采用循环操作是为了提高N2和H2的利用率 |
| D.硫酸氢钠滴加到过量的碳酸钠溶液中:CO32- + 2HSO4-=CO2 ↑+ 2SO42-+ H2O |