X、Y、Z、D、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX,ZX焰色反应为黄色;Y、D同主族,可形成DY2、DY3两种分子。请回答下列问题:
(1)D在元素周期表中的位置为为 。Y、Z、D的原子半径由大到小的顺序 (用元素符号表示)。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是 (写化学式)非金属气态氢化物中述原性最强的是 (写化学式)。
(3)由Y、G两元素形成的可作饮用水消毒剂的化合物的是 (写化学式)
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
① CH4(g)+H2O(g)=CO(g) + 3H2(g)△H =+206.0 kJ·mol-1
② CO(g)+2H2(g)=CH3OH (g)△H=-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H= 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。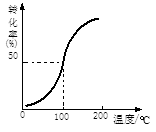
假设100℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 mol·L-1·min-1。
(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应②生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
| A.c ( H2 )减少; |
| B.平衡常数K增大; |
| C.CH3OH 的物质的量增加; |
| D.正反应速率加快,逆反应速率减慢; |
E.重新平衡c ( H2 )/ c (CH3OH )减小
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用图装置模拟上述过程,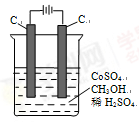
则:Co2+在阳极的电极反应式为: ;除去甲醇的离子方程式为 。
【改编】A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示: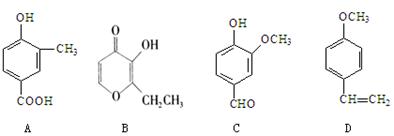
(1)D中含有的官能团的名称是 ;化合物B的分子式是 ;
(2)化合物D的核磁共振氢谱中出现 组峰;
(3)1mol A分别与足量金属钠、碳酸钠反应产生气体的体积比为 ;1molC完全燃烧消耗标准状况下氧气的体积为 ;
(4)A与乙二醇(HOCH2CH2OH)以物质的量2:1反应生成一种酯和水,请写出该反应的化学方程式(注明反应条件): 。
(5)符合下列条件的有机物C的同分异构体有___种:
①能够发生银镜反应;
②能够使FeCl3溶液显紫色;
③苯环有两个取代基
【改编】氨的合成是最重要的化工生产之一。
I.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+ H2O(g) CO(g)+ H2(g);
CO(g)+ H2(g);
②用天然气跟水蒸气反应:CH4(g)+ H2O(g) CO (g)+ 3H2(g)
CO (g)+ 3H2(g)
已知有关反应的能量变化如下图,则方法②中反应的ΔH=_____________。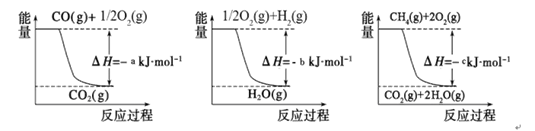
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+ N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
3 |
|
| N2的体积分数 |
ω1 |
ω2 |
ω3 |
| 混合气体密度(g·L-1) |
ρ1 |
ρ2 |
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位)。
(4)分析上表数据,下列关系正确的是________。
a.2c1=3mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=____ __(用分数表示)(mol/L)-2。
【改编】α,β不饱和化合物在有机合成中有着广泛的用途。反应①是合成α,β不饱和化合物的常见的方法。
反应①:
(1)化合物Ⅲ的分子中含氧官能团的名称为 ,1mol化合物Ⅰ完全燃烧消耗 molO2。
(2)下列说法中不正确的是 。
| A.反应①属于取代反应 |
| B.1mol化合物Ⅰ、Ⅲ与氢气完全加成均需要4mol氢气 |
| C.化合物Ⅰ、Ⅲ均能与NaHCO3溶液反应 |
| D.化合物Ⅲ与Br2既能发生取代反应,也能发生加成反应 |
(3)化合物Ⅳ可以通过化合物Ⅲ在一定条件下发生分子内的酯化得到;请写出该反应的化学方程式(注明必要的条件) 。
(4)符合下列条件的化合物Ⅳ的同分异构体有____种;
①遇氯化铁溶液显紫色;②能发生银镜反应;③苯环上只有三个取代基
(5)化合物 是由化合物Ⅴ与化合物Ⅱ发生类似反应①的反应得到的,则化合物Ⅴ的结构简式为 。在工业上化合物Ⅱ可以通过CH3CHO在一定条件下与氧气反应制得,在反应中除了生成化合物Ⅱ以外还有水生成,则该反应的化学反应方程式为 。
是由化合物Ⅴ与化合物Ⅱ发生类似反应①的反应得到的,则化合物Ⅴ的结构简式为 。在工业上化合物Ⅱ可以通过CH3CHO在一定条件下与氧气反应制得,在反应中除了生成化合物Ⅱ以外还有水生成,则该反应的化学反应方程式为 。
【原创】X、Y、Z是由1-18号元素组成的物质,它们之间存在如下转化关系。
X + H2O →Y + Z
(1)上述反应为氧化还原反应。
①若X和Y是同主族元素组成的单质,且组成X的元素位于第三周期,此反应的离子方程式是 。
②若Y和Z都可在一定条件下还原CuO,则此反应的化学方程式是 。
(2)上述反应为非氧化还原反应。
①若X是一种钠盐,Z为两性氢氧化物,则甲X的化学式为 ,Z的酸式电离方程式为 。
②若X是由N和Cl元素组成的化合物,其分子结构模型类似于氨气的结构模型,Y具有漂白性。则甲中Cl元素的化合价是 ,Z与H2O有相同的电子总数,则Z的电子式为 。