二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2: ,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16. 8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。) 
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是 。
②实验过程中,需要通入氧气。试写出一个用右图所示装置制取氧气的化学方程式 。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是 。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如右图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验: 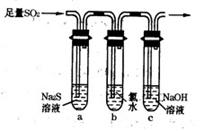
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。)】
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验: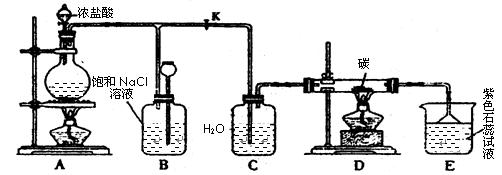
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式_____;装置C的作用是。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此处B中的现象是________________,B的作用是________________。
(13分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。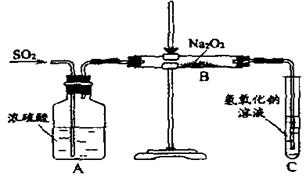
请 回答下列问题:
回答下列问题:
(1)、请写出Na2O2的电子式:;
第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,
该反应的化学方程式是:
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
上述方案是否合理?。请简要说明两点理由:
①;②。
某校化学兴趣小组用如下装置图验证NO2的氧化性和NO的还原性。
请回答下列问题:
(1)写出甲中反应的离子方程式:;
(2)说明NO2具有氧化性的现象是;
(3)说明NO具有还原性的操作和现象是;
(4)小组一成员对实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是;
经小组讨论,他们设计了以下方案,其中合理的是。
A.NO2与HCl气体混合 B.NO2与H2S气体混合 C.NO2通入Na2S溶液中
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。http://photo.blog.sina.com.cn/showpic.html - blogid=515359c40100g2jm&url=http://static1.photo.sina.com.cn/orignal/515359c4g79a02cb3d130&690http://photo.blog.sina.com.cn/showpic.html - blogid=515359c40100g2jm&url=http://static12.photo.sina.com.cn/orignal/515359c4g79a02bac230b&690
(1)完成以下实验设计表(表中不要留空格)。
| 实验 编号 |
实验目的 |
T/K |
pH |
c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参照 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
||||
| ③ |
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p—CP的浓度随时间变化的关系如下图。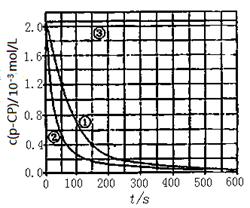
(2)请根据上图实验①曲线,计算降解反应在50~150s内的平均反应速率;v(p—CP)= mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,该降解反应速率增大。但温度过高时(如接近100℃)反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:。
(4)实验③得出的结论是:pH等于10时,。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
化学实验是实现科学探究的重要途径。请将下列有关实验的问题填写完整。
(1)下图是探究氯气性质的部分实验装置。实验室可用浓盐酸与二氧化锰共热来制取氯气,同时生成二氯化猛(MnC12)和水,该反应的化学方程式为;实验时,A装置中的KI淀粉试纸变蓝色,其原因是;B装置中可观察到的现象是;C装置中NaOH溶液的作用是,有关反应的离子方程式为。
(2)某研究性学习小组的同学用以下仪器组合的装置制取氨气,并探究氨气与氧化铜反应的性
质(已知:2NH3+3CuO
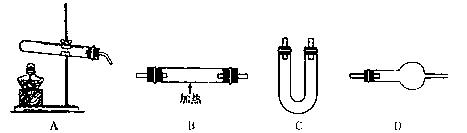
请从上图中选用所需的仪器组成一套装置制取氨气,并使氨气与氧化铜反应,同时证明该反应有水生成。下表是按仪器的连接顺序由上至下依次填写的,请将该表补充填写完整。
| 选用的仪器(填字母) |
加入的试剂 |
作用 |
| 反应器(或发生气体) |
||
| C |
||
| 氧化铜 |
使氨气与氧化铜反应 |
|