NaH与水反应的化学方程式为NaH+H2O=NaOH+H2↑,下列有关说法正确的是
| A.NaH中H的化合价为+1价,是氧化剂 |
| B.在该反应中H2O 为还原剂 |
| C.在该反应中NaH 为还原剂 |
D.该反应中电子转移的方向和数目可以表示为: |
某无色溶液中只可能含有①Na+ 、②Ba2+、③Cl一、④I一、⑤SO32一、⑥SO42一 离子中的若干种(忽略水电离出的H+、OH一),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表。下列结论正确的是
| 步骤 |
操作 |
现象 |
| ① |
用pH试纸检验 |
溶液的pH大于7 |
| ② |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈紫红色 |
| ③ |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
| ④ |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
A. 肯定含有的离子是③④⑤ B. 肯定没有的离子是②⑤
C. 可能含有的离子是①⑥D. 不能确定的离子是③⑥
下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将硫酸滴入装有亚硫酸钠固体的培养皿。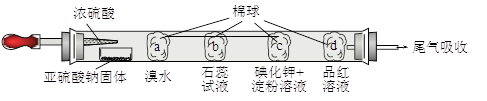
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是
| 选项 |
现象 |
解释或结论 |
| A |
a处黄色褪去 |
非金属性:Br>S |
| B |
b处变为红色 |
二氧化硫与水反应生成酸性物质 |
| C |
c处变为蓝色 |
二氧化硫具有一定的氧化性 |
| D |
d处红色先褪去后恢复 |
二氧化硫具有漂白性且漂白性不稳定 |
向10 mL 0.1mol/L NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的
| A.x=10时,溶液中有NH4+、Al3+、SO42—,且c(NH4+)>c(Al3+) |
| B.x=10时,溶液中有NH4+、AlO2—、SO42—,且c(NH4+)>c(SO42—) |
| C.x=30时,溶液中有Ba2+、AlO2—、OH—,且c(OH—)<c(AlO2—) |
| D.x=30时,溶液中有Ba2+、Al3+、OH—,且c(OH—) = c(Ba2+) |
有①②③三瓶体积相等、浓度均为1 mol/L的HCl溶液。将①加热蒸发至体积减少一半,在②中加入少量CH3COONa固体(溶液仍为酸性),③不作改变,然后以酚酞为指示剂,用标准NaOH溶液滴定上述三种溶液,终点时消耗的NaOH溶液的体积大小关系为
| A.①=③>② | B.③>②>① | C.③=②>① | D.①=②=③ |
为比较盐酸与醋酸的酸性强弱,下列方案不可行的是(均在常温下测定)
| A.比较等体积、等pH值的两种溶液的导电性 |
| B.比较等物质的量浓度的氯化钠与醋酸钠溶液的pH值 |
| C.比较等体积、等pH值的两种溶液与过量锌粉反应产生氢气的量 |
| D.比较等体积、等物质的量浓度的两种溶液稀释相同倍数后的pH变化 |