某校化学课外小组用海带为原料制取少量碘水,现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
H.静置、分层。
就此实验,完成下列填空:
(1)正确操作步骤的顺序是(用编号字母填写):
________→________→________→A→G→________→E→F。
(2)选用CCl4从碘水中萃取碘的原因是
________________________________________________________________________
________________________________________________________________________。
(3)上述E步骤的操作应注意
________________________________________________________________________
________________________________________________________________________。
(4)上述G操作的目的是
________________________________________________________________________。
(5)下列物质中,不能作为从碘水中萃取碘的溶剂是________。
A.苯 B.酒精
C.汽油 D.乙酸
(1)H、D、T三种原子,它们之间的关系是__________,在标准状况下,它们的单质的密度之比是_________,在标准状况下,1L各种单质中它们的电子数之比是______。(每空1分)
(2)某非金属X的最高正价为+m,它的最高价氧化物的水化物中有b个氧原子和一个X原子,该酸的化学式为____________。
(3)含有6.02×1023个中子的7 3Li的质量是_________g;4g D2和20g18O2的单质化合时最多可以生成__________gD218O。(每空2分)
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化。已知B分子组成中Z原子个数比C分子中少一个。
请回答下列问题:
(1)单质Z的电子式
(2)C与X在一定条件下生成化合物A的化学方程式
(3)常温下,C的水溶液能够使红色石蕊试纸变蓝,请用离子方程式表示变蓝的原因
(8分)分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
(1)以下叙述中,正确的是______。
| A.甲中锌片是负极,乙中铜片是正极 |
| B.两烧杯中铜片表面均有气泡产生 |
| C.两烧杯中溶液pH均增大 |
| D.产生气泡的速度甲中比乙中慢 |
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:乙为__________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是_________。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式________________。
(1)下列过程中不一定释放能量的是(请填编号)
A.化合反应
B.分解反应
C.形成化学键
D.燃料燃烧,
E.酸碱中和
F.炸药爆炸
(2)等质量的下列物质分别完全燃烧,放出热量较多的是(填编号)
A.硫蒸气 B.硫固体
(3)已知:通常条件下,酸碱稀溶液中和生成1mol水放出的热量为中和热。稀溶液中1molH2SO4和NaOH恰好反应时放出QkJ热量,则其中和热为kJ/mol。
(4)已知H2和O2反应放热,且断开1molH-H、1molO=O、1molO-H键需吸收的能量分别为Q1、Q2、Q3kJ。由此可以推知下列关系正确的是(填编号)
A、Q1﹥Q3,
B、Q2﹥Q3,
C、2Q1+Q2﹤2Q3,
D、2Q1+Q2﹤4Q3
E、Q1+Q2﹥Q3
F、Q1+Q2﹤Q3
、现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
有三个电子层,K、M层电子数之和等于L层电子数 |
| B |
短周期中金属性最强 |
| C |
常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D |
元素最高正价是+7价 |
(1)用化学用语回答下列问题:
B元素在周期表中的位置;
用电子式表示BD化合物的形成过程。
(2)元素D与元素A相比,非金属性较强的是D,下列表述中无法证明这一事实的是(填选项序号)。
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A最高价含氧酸的酸性弱于D最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化(反应条件和个别生成物已略去)。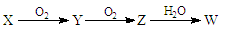
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,生成该白色沉淀的化学方程式为:;
②若X是金属单质,则Z→W的反应中氧化剂与还原剂物质的量之比为。