为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是________。
(2)验证氯气的氧化性强于碘的实验现象是________。
(3)B中溶液发生反应的离子方程式是________________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
________________________________________________________________________。
(5)过程Ⅲ实验的目的是
________________________________________________________________________。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下________________,得电子能力逐渐减弱。
用离子方程式表示下列反应:
(1)某可溶性盐的化学式XmYn(是最简结构m≠n),将一定量的该盐溶于足量的水中,若测得溶液的pH为3,该盐水解的离子方程式可能为。若测得溶液的pH为11,则该盐与水反应的离子方程式可能为。
(2)NH4Cl溶液与Na反应。
(3)AlCl3溶液与Na2S反应。
(4)CuSO4溶液与Na2S溶液反应。
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:
A(g)+2B(g)  3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
(1)达到平衡时,C在反应混合气中的体积分数是_____________(用含字母a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比(选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入Cmol。
各物质间的关系如下图,其中
、
为气态单质。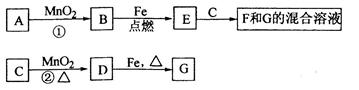
请回答下列问题:
(1)物质
和
的名称分别为、;
(2)可选用不同的
进行反应①,若能在常温下进行,其化学方程式为;
若只能在加热情况下进行,则反应物
应为;
(3)反应②的化学方程式为;
(4)新配制的
溶液应加入以防止其转化为
。检验
溶液中阳离子的常用试剂是,实验现象为。
Ⅰ固硫剂是把煤燃烧时生成的二氧化硫以盐的形式固定在炉渣中的物质,可减少二氧化硫对大气的污染。下列物质中可用做固硫剂的有
| A. | B. | C. | D. |
Ⅱ以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:
请回答下列问题:
(1)在炉气制造中,生成
的化学方程式为;
(2)炉气精制的作用是将含
的炉气、及干燥,如果炉气不经过精制,对
催化氧化的影响是 :
(3)精制炉气(含
体积分数为7%、
为ll%、
为82%)中
平衡转化率与温度及压强关系如下图所示。在实际生产中,
催化氧化反应的条件选择常压、450℃;左右(对应图中
点),而没有选择
转化率更高的
或
点对应的反应条件,其原因分别是、;
(4)在
催化氧化设备中设置热交换器的目的是、,从而充分利用能源。
I下列描述中正确的是()
| A. | 为 形的极性分子 |
| B. | 的空间构型为平面三角形 |
| C. | 中有6对完全相同的成键电子对 |
| D. | 和 的中心原子均为 杂化 |
Ⅱ金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)
原子的核外电子排布式为;
(2)
、
的晶体结构类型均与氯化钠的相同,
和
的离子半径分别为69
和78
,则熔点
(填"<"或">");
(3)
晶胞中
和
的配位数分别为、;
(4)金属镍与镧(
)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为;

(5)丁二酮肟常用于检验
:在稀氨水介质中,丁二酮肟与
反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是 键,碳氮之间的共价键类型是,氮镍之间形成的化学键是;
②该结构中,氧氢之间除共价键外还可存在; ③该结构中,碳原子的杂化轨道类型有。
③该结构中,碳原子的杂化轨道类型有。