(I)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
| ① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和__探究温度对该反应速率的影响; (Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。 |
| ② |
|
|
|
|
| ③ |
|
粗颗粒 |
|
|
| ④ |
|
|
|
(II) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)NO的平衡浓度c(NO)= ;
(2)用O2表示从0~2s内该反应的平均反应速率为 ;
(3)右图中表示NO2变化的曲线是 ;
(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V ②体积不变充入He气体 V
(10分)A、B、C为三种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E.它们之间的转化关系如下图: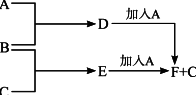
填写下列空白:
(1)物质A是________,B是________,C是________.
(2)F中加入NaOH溶液,并在空气中放置的化学方程式是________,.
(10分) (1)将一小块金属钠投入水中,发生反应的化学方程式为,请回答:可观察到的实验现象是_____________(填字母)。
a.钠沉到水底
b.钠熔成小球
c.小球四处游动
d.向反应后的溶液中滴加酚酞试剂,溶液变为红色
(2)在实验室中,通常将金属钠保存在(填字母)。
a.水中 b.煤油中 c.四氯化碳中
(3)过氧化钠与水反应,化学方程式:。
(4)过氧化钠与二氧化碳反应,化学方程式:。
回答下列关于铁元素及其化合物的知识:
(1)除去铁粉中混有的铝粉可以选用的试剂为(填序号)。
A.稀盐酸 B.氢氧化钠溶液 C.浓硫酸
(2)在常温下,铁与水并不起反应,但在高温下,铁与水蒸气可发生反应。
该反应的化学方程式;
该反应中的还原剂是,氧化剂是。
(3)实验室在保存FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是(用离子方程式表示)。
(1)SO2的摩尔质量为,1molSO2中含有氧原子的个数为,标况下5.6LSO2的质量为。
(2)用20g烧碱配制成500mL溶液,其物质的量浓度为mol/L;从中取出1mL,其物质的量浓度为mol/L;若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为mol/L。
有铜片、锌片、若干小烧杯、导线、、盐桥(含琼胶的KCl饱和溶液)、电流计、ZnSO4溶液、CuSO4溶液,试画出原电池的装置图,并说明其工作原理。
⑴原电池装置图;⑵工作原理;