在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。
问: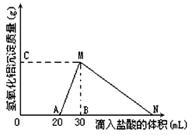
(1)此溶液中同时含有____mol___ 离子;
(2) C(或M)点的纵坐标为0.78,则c(AlO2-)为
(3) 点B的横坐标为30,则到点N处滴入的HCl溶液体积为 mL
用如图所示装置进行如下实验: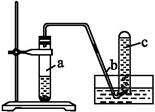
(1)在检查装置的气密性后,向试管a中加入10 mL 6 mol·L-1的稀硝酸和1 g铜片,立即用带有导管的橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式 。
(2)在实验过程中常常反应开始时速率缓慢,随后逐渐加快,这是由于 ,当反应进行一段时间后速率又逐渐减慢,原因是 。
(3)欲较快地制得NO,可采取的措施是 (填写字母序号)。
| A.加热 | B.使用铜粉 | C.稀释HNO3 | D.增大硝酸的浓度 |
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快。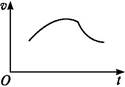
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率减慢的原因是 。
某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
1.00 |
0.00 |
| 1 |
0.90 |
0.80 |
0.20 |
| 3 |
0.75 |
0.50 |
0.50 |
| 5 |
0.65 |
0.30 |
0.70 |
| 9 |
0.55 |
0.10 |
0.90 |
| 10 |
0.55 |
0.10 |
0.90 |
| 14 |
0.55 |
0.10 |
0.90 |

(2)体系中发生反应的化学方程式是 ________________________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率: 。
在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
| 物质 时间 |
X |
Y |
Z |
Q |
| 起始/mol |
0.7 |
1 |
||
| 2 min末/mol |
0.8 |
2.7 |
0.8 |
2.7 |
| 3 min末/mol |
0.8 |
已知2 min内v(Q)="0.075" mol·L-1·min-1, 且 v(z):v(Y)=1:2
(1)试确定以下物质的相关量:
起始时n(Y)=,n(Q)=。
(2)方程式中m=,n=,p=,q=。
(3)用Z表示2 min内的反应速率。
某温度时,在2 L容器中,某一反应中A、B的物质的量随时间变化的曲线如下图所示,由图中数据分析得: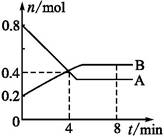
(1)在4 min末时,A、B的物质的量浓度c(A) c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A) Δc(B)(以上填“>”“<”或“=”)。
(2)从反应开始至4 min时,A的平均反应速率为 。
(3)该反应的化学方程式为 。