普通泡沫灭火器内的玻璃筒里盛Al2(SO4)3溶液,铁筒中盛NaHCO3溶液,其反应的离子方程式是
________________________________________________________________________
________________________________________________________________________。
不能把Al2(SO4)3溶液盛在铁筒中的原因是
________________________________________________________________________
________________________________________________________________________。
不用溶解度较大的Na2CO3代替NaHCO3的原因是
________________________________________________________________________。
(9分)
(1)请用下列10种物质的序号填空:①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:______________;若XY2为共价化合物时,其结构式为:__________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103 Pa),但在180℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是______________________________________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是______;
| A.c和f | B.b和g | C.d和g | D.b和e |
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式______。
(9分)
(1)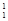 H、
H、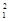 H、
H、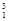 H互为________,16O2、18O3互为________。
H互为________,16O2、18O3互为________。
| A.同位素 | B.相同物质 |
| C.同素异形体 | D.同分异构体 |
(2)某元素的最高价氧化物分子式R2O5,已知R的气态氢化物中含氢8.82%,则R的相对原子量约为________,R元素周期表中的位置为________________。
(3)铷和另一种碱金属形成的合金7.8 g与足量的水反应后,产生0.2 g氢气,则此合金中另一碱金属可能是:________________。(铷的相对原子量取85.5)
(4)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为________。
(12分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。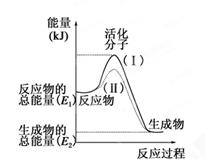
(1)图中所示反应是________(填“吸热”或“放热”)反应。
(2)已知拆开1mol H—H键、1mol I—I、1mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)________kJ的热量。在化学反应过程中,是将______转化为________。
(3)50mL 0.50mol•L﹣1盐酸与50mL 0.55mol•L﹣1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题: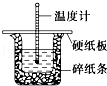
①从实验装置上看,图中尚缺少的一种玻璃用品是.
②烧杯间填满碎纸条的作用是.
③大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”或“无影响”).
④实验中改用60mL 0.50mol•L﹣1盐酸跟50 mL 0.55mol•L﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由:。
⑤用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会(均填“偏大”、“偏小”或“无影响”)
填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:___________。
(2)周期表中位于第8纵行的铁元素属于第族。
(3)周期表中最活泼的非金属元素位于第纵行。
(4)所含元素超过18种的周期是第、周期
(5)请写出298K,101KPa时,下列反应的热化学方程式:
用CO(g)还原1mol Fe2O3(s)放热24.8KJ 。
(本题共14分)碱金属元素按原子序数增大,依次为:锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr,放射性元素)。请回答:
52.常温常压下,将一定量锂单质投入到一定量重水中,锂完全反应,产生1.6g气体,过滤得到6.75g沉淀和100mL澄清溶液。则得到的澄清溶液中溶质的物质的量浓度为。
53.钠钾合金许多特殊反应中有着非常重要的应用。取59.80g钠钾合金和一定量四氯化碳在一定条件下恰好完全反应,制造出5.40g纳米级金刚石粉末。则该钠钾合金中钠元素和钾元素的质量比为。
54.某同学在实验室模拟制备纯碱。0.600 mol NH3和35.100g食盐混合,得到氨盐水总质量为105.300 g。向该溶液通入CO2至反应完全,过滤,得到滤液88.200g,则NaHCO3的产率为______________。(保留三位小数)
55.一定条件下,85.5g铷与氧气和臭氧的混合气体22.4L(已折算为标况,且该混合气体对相同状况下氢气的相对密度为20.8)恰好完全反应,得到两种离子化合物A和B的固体混合物。A和B中,阴阳离子个数比均为1:1且均存在两种微粒间作用力,A的含氧量为0.3596。则化合物A的化学式为。
将上述固体混合物加热,A可分解生成B和氧气。加热一段时间后,固体混合物中两种阴离子的物质的量相等,则分解产生的氧气在标况下的体积为。