(2012年高考安徽卷)氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时:
①HF(aq)+OH-(aq)===F-(aq)+H2O(l) ΔH=-67.7 kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
在20 mL 0.1 mol·L-1氢氟酸中加入V mL 0.1 mol·L-1NaOH溶液。下列有关说法正确的是( )
| A.氢氟酸的电离方程式及热效应可表示为:HF(aq) F-(aq)+H+(aq) ΔH=+10.4 kJ·mol-1 |
| B.当V=20时,溶液中:c(OH-)=c(HF)+c(H+) |
| C.当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol·L-1 |
| D.当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>c(H+) |
烃分子中若含有双键、三键或单键的环,氢原子数就少,分子就不饱和,亦即具有一定的“不饱和度”,其数值可表示为:不饱和度(Ω)=双键数+环数+三键数×2。则有机物 的不饱和度Ω为( )
的不饱和度Ω为( )
| A.8 | B.7 | C.6 | D.5 |
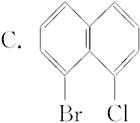
现有下列一些萘的衍生物的结构简式,与 互为同分异构体的是( )
互为同分异构体的是( )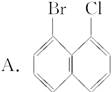


在一定条件下,萘可以被硝硫混酸硝化生成二硝基物,它是1,5-二硝基萘 和1,8-二硝基萘
和1,8-二硝基萘 的混合物。后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可以将这两种异构体分离。将上述硝化产物加入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采用的方法是( )
的混合物。后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可以将这两种异构体分离。将上述硝化产物加入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采用的方法是( )
| A.蒸发浓缩结晶 |
| B.向滤液中加水后过滤 |
| C.用碳酸钠溶液处理滤液 |
| D.将滤液缓缓加入水中 |
对于有机物
的命名正确的是( )
| A.4-甲基-6-乙基庚烷 |
| B.3,5-二甲基辛烷 |
| C.2-甲基-1,4-二乙基戊烷 |
| D.3,6-二甲基辛烷 |
常温下,一种烷烃A和一种单烯烃B组成混合气体,A或B分子最多只含有4个碳原子,且B分子的碳原子比A分子的多。试求:
(1)将1 L该混合气体充分燃烧,在同温同压下得到2.5 L CO2气体。试推断原混合气体中A和B所有可能的组合及其体积比,并将结果填入下表:
| 组合编号 |
A的分子式 |
B的分子式 |
A和B的体积比(VA∶VB) |
| ① |
|||
| ② |
|||
| ③ |
|||
| ④ |
(2)120 ℃时取1 L该混合气体与9 L O2混合,充分燃烧后,当恢复到120 ℃和燃烧前的压强时体积增大6.25%,试通过计算确定A和B的分子式。A:_________;B_________。