三氯化铁熔点282 ℃、沸点315 ℃,能吸收空气里的水分而潮解。它可广泛用于污水处理、电子工业、印染业、建筑业,某化学实验小组的同学欲用下列仪器制备FeCl3固体。
(1)写出制备氯气时的离子方程式_______________________
(2)所选用的仪器连接顺序(填写接口字母)为___________n→d__________
(3)实验过程中,给A、B仪器加热的顺序为_____________________,这样操作的目的是_______________,可作为点燃B处酒精灯的实验标志是_________________;若C可以用D代替,则使用C的目的是______________________。若缺少此类装置,此B中可能发生的另一个反应的方程式为________________________。
(4)有同学认为,若不使用E装置,则B中会有FeCl2生成,请设计一个实验确定此观点是否正确________________________________________________________________。
中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器有:____________________,在大小烧杯之间填满碎泡沫(或纸条)其作用是____________________。
(2)该实验可用0.60 mol·L-1 HCl和0.65 mol·L-1的NaOH溶液各50 mL。NaOH的浓度大于HCl的浓度作用是_____。当室温低于10℃时进行,对实验结果会造成较大的误差其原因是_________。
(3)若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C=4.18 J/(g·℃),则该中和反应放出热量为_____________kJ(填表达式),ΔH="___________" kJ/mol(填表达式)。
(8分) 实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: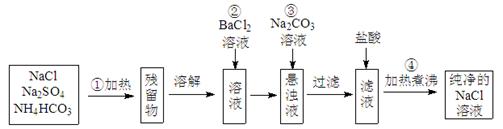
如果此方案正确,那么:
(1)操作①中碳酸氢铵受热(100℃以上)可分解生成氨气、水和二氧化碳的混合气,该混合气的平均摩尔质量为。(数值保留到小数点后一位)
(2)操作②为什么不能改为加硝酸钡溶液?__________________________________。
(3)操作③的目的是__________________________________(结合化学方程式回答)。
(4)操作④的目的是____________________________________________________。
用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制100mL1.84mol·L-1的稀硫酸,若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒,F.胶头滴管;G.50mL烧杯;H.100mL容量瓶,
a.实验时应选用仪器的先后顺序是(填入编号):。
b.在容量瓶的使用方法中,下列操作不正确的是(填编号)________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2~3cm处,用滴管加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后,直接倒入容量瓶中,缓慢加入蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
F.往容量瓶中转移溶液时应用玻璃棒引流
c.在配制溶液时,下列操作出现的后果是(填:“偏低”、“偏高”、“无影响”):
(1)配制硫酸溶液时,容量瓶中有少量水。 ______________。
(2)未洗涤烧杯和玻璃棒。__________。
(3)配制好溶液、摇匀后,容量瓶未塞好,洒出一些溶液。_____________。
(4)定容时,俯视读数。________________。
(5)定容时,液面上方与刻度相齐时,停止加水。________________。
(6)定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。____________。
(共6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据: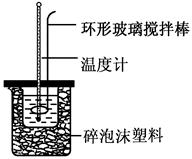
| 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
NaOH溶液 |
||
| 1 |
20.2 |
20.3 |
23.7 |
| 2 |
20.3 |
20.5 |
23.8 |
| 3 |
21.5 |
21.6 |
24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是。
(2)在操作正确的前提下,提高中和热测定准确性的关键是。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH=[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将(填“偏大”、“偏小”、 “不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大
欲用98%的浓硫酸(密度为1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①玻璃棒,②烧杯,③量筒,④胶头滴管,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
| A.用量筒量取浓H2SO4 |
| B.反复颠倒摇匀 |
| C.用胶头滴管加蒸馏水至刻度线 |
| D.洗净所用仪器 |
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为____________________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度__________(选填“偏高”、“偏低”、“无影响”,以下同。)
③在转入容量瓶前烧杯中液体应____________,否则会使浓度____________;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度____________。
④定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度____________;仰视则使浓度__________。