将一定质量的镁和铝的混合物投入100ml盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列说法正确的是
| A.镁和铝的总质量为9g |
| B.盐酸的物质的量浓度为5 mol·L-1 |
| C.NaOH溶液的物质的量浓度为5 mol·L-1 |
| D.生成的氢气在标准状况下的体积为11.2 L |
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是 ( )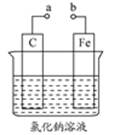
| A.a和b分别与电源的负极正极相连时,电解氯化钠溶液产生氯气 |
| B.a和b用导线连接时,碳棒上发生的反应为:O2+2H2O+4e-=4OH- |
| C.若往溶液中加少许硫酸,无论a和b是否连接,铁片均会溶解,溶液逐渐变成浅绿色 |
| D.若氯化钠溶液改为氯化铵溶液,a和b连接,碳棒上有气泡产生 |
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
| A.水既是氧化剂又是溶剂 |
| B.放电时正极上有氢气生成 |
| C.放电时OH-向正极移动 |
| D.总反应为:2 Li+2H2O=2 LiOH+H2↑ |
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是 ( )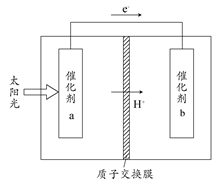
| A.该过程是将太阳能转化为化学能的过程 |
| B.催化剂a表面发生氧化反应,有O2产生 |
| C.催化剂a附近酸性减弱,催化剂b附近酸性增强 |
| D.催化剂b表面的反应是CO2+2H++2e-=HCOOH |
中华商务网讯:2011年中国将超北美成为全球液晶显示器第二大市场。生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年,以下是几种化学键的键能:
| 化学键 |
N≡N |
F—F |
N—F |
| 键能/(kJ·mol-1) |
941.7 |
154.8 |
283.0 |
下列说法中正确的是 ( )
A.过程N2(g)→2N(g)放出能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)→2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
固体A的化学式为NH5,它的所有原子的最外层电子结构都符合相应稀有气体原子的最外层电子结构,则下列有关说法中不正确的是 ( )
| A.NH5中既有离子键又有共价键 |
| B.NH5的熔沸点高于NH3 |
| C.1 mol NH5中含有5 mol N—H键 |
| D.将固体A投入少量水中,可生成H2和NH3·H2O |