已知有以下物质相互转化
焰色反应显紫色,说明D溶液中含有K元素。又因为D能和硝酸银溶液反应生成白色沉淀氯化银,所以D应该是氯化钾。EF的转化以及沉淀颜色可知,E是氢氧化亚铁、F是氢氧化铁,G则氯化铁。B和C反应生成氯化钾和氢氧化亚铁,所以BC是氢氧化钾和氯化亚铁。G能和A反应生成B,所以A是铁,B是氯化亚铁,C是氢氧化钾,气体是氢气。
试回答:试回答:(1)写出E的化学式 ,H的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)检验G溶液中的金属阳离子的方法是: ;
向G溶液加入A的有关离子反应方程式 。
(4)写出A在一定条件下与水反应的化学方程式 。
喹硫平可用于精神疾病的治疗,它的合成路线如下: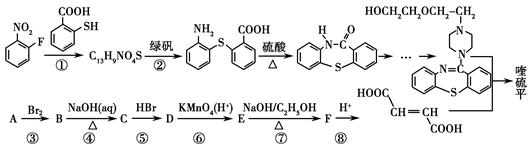
(1)写出C13H9NO4S中所有含氧官能团的名称:________。
(2)A属于烃,且相对分子质量是54,写出A的结构简式:____________。
(3)反应①~⑤中属于取代反应的有________(填序号)。
写出反应⑦的化学方程式:__________________________________________。
(4)流程中设计反应⑤和⑦的目的是___________________________________。
(5)物质C的同分异构体有多种,其中既含有羟基,又含有醛基的同分异构体有________种。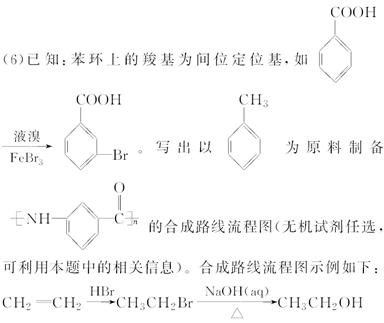
莫沙朵林是一种镇痛药,它的合成路线如下: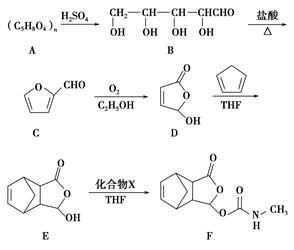
(1)B中手性碳原子数为________;化合物D中含氧官能团的名称为________。
(2)C与新制氢氧化铜反应的化学方程式为_______________________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:_________________________________________________。
①核磁共振氢谱有4个峰;
②能发生银镜反应和水解反应;
③能与FeCl3溶液发生显色反应。
(4)已知E+X―→F为加成反应,化合物X的结构简式为____________。
(5)已知: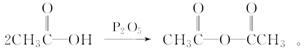 化合物
化合物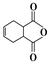 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以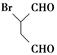 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
CH3CH2OH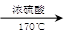 CH2===CH2
CH2===CH2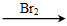
化合物F(匹伐他汀)用于高胆固醇血症的治疗,其合成路线如下: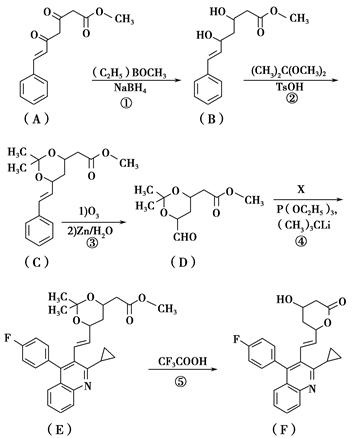
(1)化合物D中官能团的名称为________、________和酯键。
(2)A→B的反应类型是____________。
(3)写出同时满足下列条件的A的一种同分异构体的结构简式:________________。
①分子中含有两个苯环;②分子中有3种不同化学环境的氢;③不含—O—O—。
(4)实现D→E的转化中,化合物X的分子式为C19H15NFBr,写出其结构简式:________________。
(5)已知:化合物E在CF3COOH催化作用下先转化为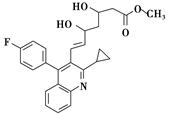 ,再转化为F。你认为合成路线中设计步骤②的目的是___________________________________________________。
,再转化为F。你认为合成路线中设计步骤②的目的是___________________________________________________。
(6)上述合成路线中,步骤③的产物除D外还生成 ,该反应原理在有机合成中具有广泛应用。试写出以
,该反应原理在有机合成中具有广泛应用。试写出以 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: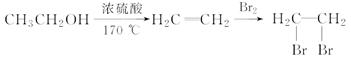
Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。
钴的有关性质如下:Co(OH)2具有两性。钴的主要物理、化学参数与铁、镍接近,属铁族元素。
结合以上信息试回答下列问题:
(1)Co(OH)2的制备是在CoCl2溶液中加稍过量的氨水,不用NaOH溶液的原因是________________________________(用化学方程式表示)。制得的Co(OH)2不宜在空气中长期放置,会被空气中的O2氧化,化学方程式为_____________________________________________________。
(2)如图,已知钴的氢氧化物加热至290 ℃时已完全脱水,则1000 ℃时,剩余固体的成分为________________________(填化学式);在290~500 ℃范围内,发生的反应的化学方程式为__________________________________________。
(3)已知常温下,在0.10 mol·L-1 CoCl2溶液中加入氨水充分搅拌,有Co(OH)2沉淀生成,当溶液的pH=8时,c(Co2+)=________mol·L-1(Ksp[Co(OH)2]=1.6×10-15)。常温下反应Co2++2H2OCo(OH)2+2H+的平衡常数为
_______________________________。
银铜合金广泛用于航空工业,从切割废料中回收银并制备铜化工产品的工艺如下: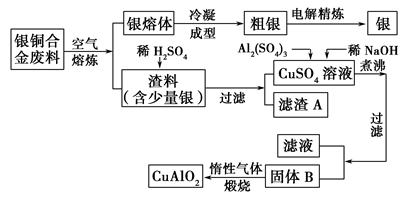
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃。)
(1)电解精炼银时,阴极反应式为________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学反应方程式为________________。
(2)固体混合物B的组成为__________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为____________。
(3)完成煅烧过程中一个反应的化学方程式:____CuO+____Al2O3 ____CuAlO2+________↑。
____CuAlO2+________↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0 kg废料中的铜可完全转化为________ mol CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液________ L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是________、过滤、洗涤和干燥。