某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
| 实验 |
药品 |
制取气体 |
量气管中液体 |
| Ⅰ |
Cu,稀HNO3 |
NO |
H2O |
| Ⅱ |
NaOH(s),浓氨水 |
NH3 |
|
| Ⅲ |
镁铝合金、NaOH溶液 |
H2 |
H2O |

(1)仪器A的名称是 。
(2)实验Ⅰ反应的离子方程式是 。
(3)实验Ⅱ中量气管中的液体最好是 ( )(填字母编号,下同)
a.浓NaOH溶液 b.煤油 c.氨水 d.氯化铵溶液
该实验剩余的NH3需吸收处理.以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有( )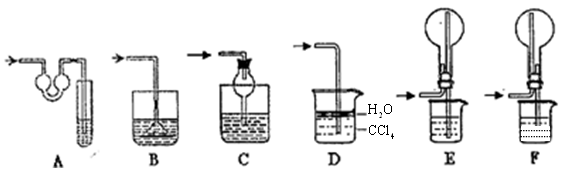
(4)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温.②视线与凹液面最低处相平.③ 。
(5)实验Ⅲ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 |
镁铝合金度量 |
量气管第一次读数 |
量气管第二次读数 |
| ① |
1.0g |
10.0mL |
346.3mL |
| ② |
1.0g |
10.0mL |
335.0mL |
| ③ |
1.0g |
10.0mL |
345.7mL |
根据上述数据,可计算出镁铝合金中铝的质量分数为____________________。
增加反应物浓度可以加快化学反应速率。已知:反应Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O出现浑浊的快慢与浓度有关。现有0.1mol/L的Na2S2O3溶液和0.1mol/L的H2SO4溶液和蒸馏水;实验用品有:烧杯、试管、量筒、胶头滴管、秒表等,请设计一个实验通过较明显的实验事实证明上述结论(说明实验操作、现象及结论)。
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。⑴提出假设①该反应的气体产物是CO2。②该反应的气体产物是CO。③该反应的气体产物是。
⑵设计方案如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。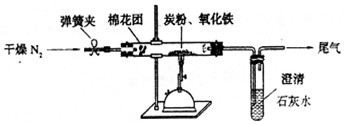
⑶查阅资料
氮气不与碳、氧化铁
发生反应。实验室可
以用氯化铵饱和溶液和
亚硝酸钠(NaNO2)饱
和溶液混合加热反应制
得氮气。请写出该反应的离子方程式:。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、0.48g碳粉混均匀,放入50.00g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为
。
⑸数据处理试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:。zx
用于分离提纯物质的方法有多种,请根据下列实验要求填空:
(1)分离饱和食盐水和泥沙的混合物,分离方法为,所用的玻璃仪器有。
(2)分离相溶的CCl4(沸点76.75℃)和甲苯(沸点110.6℃)的混合物,分离方法为 。
(3)从碘水里提取并得到固体碘,应先进行、操作,再进行操作。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
⑴在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入__________,目的是__________。
⑵反应中加入过量乙醇,目的是__________________________。
⑶如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加乙酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是________
______________________________________________。
⑷现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,下列框图是分离操作步骤流程图: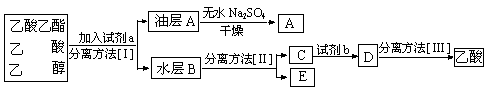
则试剂a是:____________,分离方法III是______________。
⑸甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液,中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人实验结果如下:
甲得到了显酸性的酯的混合物;
乙得到了大量水溶性的物质;
丙同学分析了上述实验目标产物后,认为上述实验都没有成功。
试解答下列问题:
①甲实验失败的原因是_______________________________________________。
②乙实验失败的原因是_______________________________________________。
用下列仪器的编号回答问题:①容量瓶②蒸馏烧瓶③分液漏斗④量筒⑤试管⑥烧杯⑦蒸发皿⑧坩埚
(1)可以直接用酒精灯加热的是;
(2)使用时必须检查是否漏水的是。