下面是几种有机物的结构简式: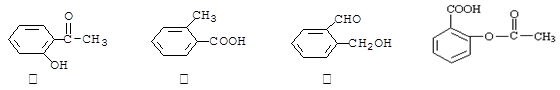
丁
其中,(1)互为同分异构体的有 (从甲、乙、丙、丁中选出)。
(2)能与NaHCO3溶液反应的有: ;能够发生水解反应的有: 。
(3)写出丙中含有的含氧官能团的名称 。
(4)请写出鉴别甲的方法(指明所选试剂及主要现象): 。
(5)写出丙物质发生银镜反应的化学方程式: 。
全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg·L-1。其工业提取法有:
⑴空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有:①_________________(写出化学方程式)
②3Br2+3CO32-=BrO3-+5Br-+3CO2↑;
③BrO3- +5Br-+6H+=3Br2+3H2O。
其中反应②中氧化剂是____________,还原剂是___________
⑵空气吹出SO2吸收法。该方法基本同⑴,只是将吹出的溴用SO2来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式 ____________________ 。
⑶溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是 ___________。下列可以用于海水中溴的萃取的试剂是 __________。①乙醇,②四氯化碳,③硝酸
写出下列方程式(10分 每空2分)
(1)金属铝和氢氧化钠溶液反应(离子方程式)
(2)氢氧化亚铁放在空气中变为红褐色
(3)工业制漂白粉
(4)高温条件下铝和五氧化二钒(V2O5)反应
(5)工业冶炼铝
已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大。A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素。
回答下列问题:
(1)写出下列元素的符号:A _____、 B_____、C______;
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是__________,(填写化学式)碱性最强的是_________;(填写电子式)
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是_____,电负性最大的元素是__________;
(4)在AD3分子中A元素原子的原子轨道发生的是杂化,分子空间构型为;
(5)将B 的单质投入E的最高价氧化物对应水化物中,发生反应生成物中有此离子[B(OH)4]–离子方程式是___________________________________。
(6)石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的E单质相互作用,形成某种青铜色的物质(其中的元素E用“●”表示),原子分布如图所示,该物质的化学式为。
过渡金属元素氧化物的应用研究是目前科学研究的前沿之一。2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如下图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
(1)用A、B、O(氧)表示此类特殊晶体的化学式;
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为;(用含x的代数式表示)
(3)Mn的外围电子排布式为,在元素周期表中的位置是第周期,第族;
(4)下列有关说法正确的是。
A.镧、锰、氧分别位于周期表f、d、p区
B.CaO的熔点为2614℃,属于原子晶体
C.铬的堆积方式与钾相同,则其堆积方式如下图:
D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子核外电子排布图为______________________________;
(2)写出与H2O分子互为等电子体的微粒______________________(填2种);
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是___________;
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(4)在冰晶体中,以一个水分子为中心,画出水分子间最基本的连接方式(水分子用结构式表示);
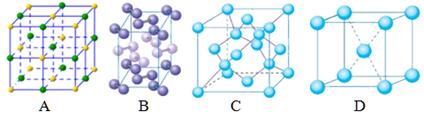
(5)下列是钾、碘、金刚石、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_____,D晶体的空间利用率为。