已知A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大。A原子的价电子层的p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素的原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素。
回答下列问题:
(1)写出下列元素的符号:A _____、 B_____、C______;
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是__________,(填写化学式)碱性最强的是_________;(填写电子式)
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是_____,电负性最大的元素是__________;
(4)在AD3分子中A元素原子的原子轨道发生的是 杂化,分子空间构型为 ;
(5)将B 的单质投入E的最高价氧化物对应水化物中,发生反应生成物中有此离子[B(OH)4]–离子方程式是___________________________________。
(6)石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的E单质相互作用,形成某种青铜色的物质(其中的元素E用“●”表示),原子分布如图所示,该物质的化学式为 。
(12分)中学化学实验,淡黄色的pH试纸常用于测定溶液的酸碱性。在25 ℃,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色。而要精确测定溶液的pH,需用pH计。pH计主要通过测定溶液中H+浓度来测定溶液的pH。
(1)已知水中存在如下平衡H2O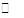 H++OH-ΔH>0。现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是(填字母)。
H++OH-ΔH>0。现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是(填字母)。
| A.向水中加入NaHSO4溶液 |
| B.向水中加入Cu(NO3)2溶液 |
| C.加热水至100 ℃[其中c(H+)=1×10-6 mol·L-1] |
| D.在水中加入(NH4)2SO4溶液 |
(2)现欲测定100 ℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显色,若用pH计测定,则pH7 (填“>”“<”或“=”),溶液呈性(填“酸”“碱”或“中”)。
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
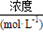 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性为,试样的pH=。
(14分)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子最外层电子排布为3s23p1,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)则W为,X为,Y为,Z为。(填元素符号)
W的气态氢化物稳定性比H2O(g) (填“强”或“弱”)。
(2)Z原子的基态原子核外电子排布式是,Y的电负性比X的________(填“大”或“小”),W的第一电离能比O的(填“大”或“小”)。
(3)X的最高价氧化物对应水化物与NaOH溶液反应的离子方程式是。
(1)有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为________________________。
(2)已知难溶电解质溶解平衡时M(OH)2(s)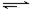 M2+(aq) +2OH— (aq),溶液的pH=a,则其Ksp=。
M2+(aq) +2OH— (aq),溶液的pH=a,则其Ksp=。
(3)溶液的酸度表示为AG=lg[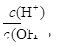 ],又知100℃时,水的离子积常数为1×10—12,25℃时纯水的AG1和100℃时食盐水的AG2的关系为:AG1AG2(=、<、>);在100℃时将V1ml AG=8的硫酸与V2ml AG=—6的烧碱溶液混合后AG=0,则V1:V2=。
],又知100℃时,水的离子积常数为1×10—12,25℃时纯水的AG1和100℃时食盐水的AG2的关系为:AG1AG2(=、<、>);在100℃时将V1ml AG=8的硫酸与V2ml AG=—6的烧碱溶液混合后AG=0,则V1:V2=。
Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是____________________。
(2)为便于储存,要将氯气液化[ Cl2(g) 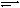 Cl2(l) ],应采取的措施是_____(写出一条即可)。
Cl2(l) ],应采取的措施是_____(写出一条即可)。
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 |
 |
| 储运要求 |
远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 |
NaOH、NaHSO3溶液吸收 |
| 包装 |
钢瓶 |
① 用离子方程式表示“泄漏处理”中NaHSO3溶液的作用_______。
② 若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是。
③ 氯气含量检测仪工作原理示意图如下图甲所示,则Cl2在Pt电极放电的电极反应式是_______。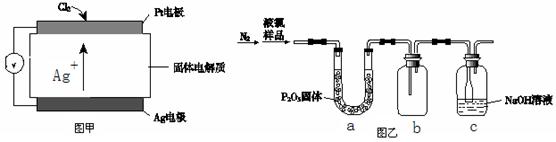
(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0. 4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如上图乙所示:
① 用离子方程式说明c装置的作用_______。
② 检测液氯的含水量,根据上图,需要测定的数据是_______。
有关硫化物的几个问题。
(1)H2S在空气中可以燃烧。
已知:① 2H2S(g) + O2(g) 2S(s) + 2H2O(g)ΔH= -442.38 kJ/mol
2S(s) + 2H2O(g)ΔH= -442.38 kJ/mol
②S(s) + O2(g)  SO2(g)ΔH= -297.04 kJ/mol
SO2(g)ΔH= -297.04 kJ/mol
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会(填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是。
④ 在上述反应的同时需要大量鼓入空气,其原因是。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程:。