(14分)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子最外层电子排布为3s23p1,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)则W为 ,X为 ,Y为 ,Z为 。(填元素符号)
W的气态氢化物稳定性比H2O(g) (填“强”或“弱”)。
(2)Z原子的基态原子核外电子排布式是 ,Y的电负性比X的________(填“大”或“小”),W的第一电离能比O的 (填“大”或“小”)。
(3)X的最高价氧化物对应水化物与NaOH溶液反应的离子方程式是 。
[化学—选修化学与技术]
七铝十二钙(12CaO•7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
(1)锻粉主要含MgO和_______,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,或滤液Ⅰ中c(Mg2+)小于5×10-6mol•L-1,则溶液pH大于______;该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_______。(Mg(OH)2的Ksp=5×10-12)
(2)滤液Ⅰ中阴离子有__________(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成_________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为_________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为_________。
(5)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为_________。
运用化学反应原理研究部分单质及其化合物的反应有重要意义。 (1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g) 2NH3(g)。请回答:
2NH3(g)。请回答:
①已知:H-H键能为436kJ/mol,N N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=_________。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不”);
②如图中:当温度由T1变化到T2时,KA______KB(填“>”、“<”或“=”)。
(2)氨气溶于水得到氨水。NO2可用氨水吸收生成NH4NO3,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___________(用离子方程式表示),向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(用含a、b的代数式表示),(NH3·H2O的电离平衡常数取Kb=2×10-5mol/L)
(3)硫酸生产中,SO2催化氧化生成SO3:SO2(g)+1/2O2(g) SO3(g)△H<0,是工业上生产硫酸的关键步骤。
SO3(g)△H<0,是工业上生产硫酸的关键步骤。
①在某温度时,该反应的平衡常数K=0.75,若在此温度下,向100L的恒容密闭容器中,充入3mol SO2、4mol O2和4mol SO3,则反应开始时正反应速率________逆反应速率(填“<”、“>”或“=”)。
②在①中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________。
a.保持温度和容器体积不变,充入1.0mol SO3(g)
b.保持温度和容器内压强不变,充入2.0mol He
c.降低温度
d.在其他条件不变时,减小容器的容积
③由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种 沉淀共存时, =_________。
=_________。
[已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)=5.2×10-9]
某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如下实验: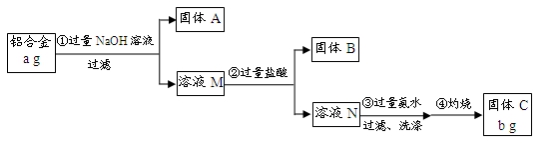
已知:(1)该铝合金的主要成分为铝、镁、铜、硅。
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O===Na2SiO3+2H2↑。
(3)硅酸不溶于水
(4)固体C为Al2O3
请回答下列问题:
(1)固体A在潮湿的空气中久置可能会发生一个明显的变化,这个变化是 ;发生反应的化学方程式为 ;
(2)步骤③中洗涤沉淀的实验操作为 ;
(3)该样品中铝的质量分数是 (用a、b表示);
(4)下列因操作不当,会使测定结果偏大的是 ;
A.第③步中沉淀未用蒸馏水洗涤
B.第①步中加入NaOH溶液不足
C.第④步对沉淀灼烧不充分
钠、铝和铁是三种重要的金属。请回答:
(1)三种金属中, (填名称)既能与盐酸又能与氢氧化钠溶液反应,写出该物质与氢氧化钠溶液反应的离子方程式 。该反应中,氧化剂是 ,氧化产物是 ,每生成1mol氧化产物,转移电子的数目约为 。
(2)三种金属在一定条件下均能与水发生反应。其中,铁与水蒸气反应的化学方程式为_______________________。钠与水反应时一定可观察到的实验现象有__________(填序号)。
a. 钠沉入水底 b.溶液变为红色 c. 钠四处游动 d. 钠熔成小球
在实验室中,通常将金属钠保存在 中;钠与水反应的化学方程式为 。
实验室可以用高锰酸钾和浓盐酸反应制取氯气(Cl2),反应的化学方程式如下:
2KMnO4+16HCl(浓)="=2KCl" + 2MnCl2 + 5Cl2↑ +8H2O
(1)用单线桥法标出电子转移的方向和数目。
(2)该反应中的氧化剂与还原剂物质的量之比是 。
(3)KMnO4的氧化性比Cl2的氧化性 (选填“强”或“弱”)。
(4)如反应中转移了2mol电子,则产生的Cl2在标准状况下体积为 。
(5)某同学欲用KMnO4固体配制90 mL0.5mol/L的溶液。回答下列问题:
①配制KMnO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、 、 。
②应用托盘天平称取KMnO4固体 g。
③不规范的实验操作会导致实验结果的误差。下列操作会导致所配溶液浓度偏低的是 。
| A.加水定容时俯视刻度线 |
| B.容量瓶内壁附有水珠而未干燥处理 |
| C.颠倒摇匀后发现凹液面低于刻度线又加水补上 |
| D.在溶解过程中有少量液体溅出烧杯外 |