[化学—选修 化学与技术]
七铝十二钙(12CaO•7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:

(1)锻粉主要含MgO和_______,用适量NH4NO3溶液浸取煅粉后,镁化合物几乎不溶,或滤液Ⅰ中c(Mg2+)小于5×10-6mol•L-1,则溶液pH大于______;该工艺中不能用(NH4)2SO4代替NH4NO3,原因是_______。(Mg(OH)2的Ksp=5×10-12)
(2)滤液Ⅰ中阴离子有__________(忽略杂质成分的影响);若滤液Ⅰ中仅通入CO2,会生成_________,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为_________。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为_________。
(5)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为_________。
(8分)单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多1,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀,各物质间的转化关系如图所示(反应条件多数已略去):
请回答:
(1)反应⑥的离子方程式是_______________________________________________。
(2)甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是________。
(3)在反应①中,已知1 g B完全燃烧生成液态D时,放出142.9 kJ的热量,则表示B的燃烧热的热化学方程式是_______________________________________________
________________________________________________________________________。
(4)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是________________________________________________________
________________________________________________________________________。
(5)反应③④在通常情况下不能自发进行,框图中的条件a是________,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式________________________________________________________________________。
(8分)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
________________________________________________________________________
________________________________________________________________________。
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式
________________________________________________________________________。
(3)如图是101 kPa时氢气在氯气中点燃生成氯化氢气体的能量变化示意图: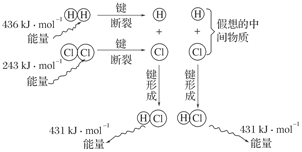
写出此反应的热化学方程式_________________________________________________。
(4)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)
ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式________________________________________________________________________。
(8分)用CH4催化还原NOx可以消除氮氧化物的污染。
例如:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为________(阿伏加德罗常数用NA表示),放出的热量为________kJ。
(2)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)(l)。丙烷脱氢可得丙烯。
已知:C3H8(g)―→CH4(g)+HC≡CH(g)+H2(g)
ΔH1=+156.6 kJ·mol-1
CH3CH===CH2(g)―→CH4(g)+HC≡CH(g)
ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)―→CH3CH===CH2(g)+H2(g)的ΔH=________kJ·mol-1。
乙烯与乙烷混合气体共amol,与bmol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混和气体和45g水。
(1)当a=1时,乙烯和乙烷的物质的量的比是
(2)当a=1且反应后和混合气体的物质的量为反应前氧气的三分之二时,则b=; 得到的CO和CO2的物质的量之比是
(3)a的取值范围是
某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,
已知:As是产物之一。
(1)写出并配平该反应的化学方程式 ______________
(2)在该反应中,得电子的物质是______________ ,被氧化的元素是______________;
(3)在反应中,每转移1 mol电子,消耗(或生成)HCl_______mol;
(4)下列叙述正确的是_____________(填写序号)。
a.在相同条件下,第VIIA族元素的阴离子的还原性从上到下逐渐增强
b.Sn和Pb位于同一主族,其+4价的化合物均很稳定
c.在相同条件下,还原性顺序:S2->I->Fe2+>Br->Cl-
d. 在上市反应中,氧化性:SnCl2 >As还原性:H3AsO3>H2SnCl6