某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,
已知:As是产物之一。
(1)写出并配平该反应的化学方程式 ______________
(2)在该反应中,得电子的物质是______________ ,被氧化的元素是______________;
(3)在反应中,每转移1 mol电子,消耗(或生成)HCl_______mol;
(4)下列叙述正确的是_____________(填写序号)。
a.在相同条件下,第VIIA族元素的阴离子的还原性从上到下逐渐增强
b.Sn和Pb位于同一主族,其+4价的化合物均很稳定
c.在相同条件下,还原性顺序:S2->I->Fe2+>Br->Cl-
d. 在上市反应中,氧化性:SnCl2 >As还原性:H3AsO3>H2SnCl6
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+ I2(g) 2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为。
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K(填写增大、减小或不变),HI浓度的变化正确的是(用图2中a-c的编号回答)。
②若加入I2,则H2浓度的变化正确的是(用图2中d-f的编号回答)。
A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A与E、D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,A与B、C、D可分别形成10电子分子,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,请回答下列问题:
(1)B在元素周期表中的位置是。
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是。
E、F元素最高价氧化物对应水化物之间反应的离子方程式为。
(3)E在D2中燃烧生成化合物X,则X的电子式是:。
某化学小组用下图装置电解CuCl2溶液制少量漂白液: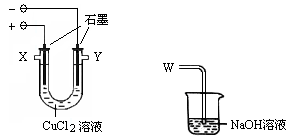
(1)其阳极的反应式是:;导气管W端应与出气口连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。某化学兴趣小组查阅资料可知:
| 物质名称及化学式 |
氯化亚铜CuCl |
碱式氯化铜Cu2(OH)3Cl |
| 性质 |
白色固体、不溶水 |
绿色固体、不溶水 |
化学小组分析提出:①红色物质可能有Cu或Cu2O、或二者都有;②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入下图所示装置b中,进行实验。
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g 。
①碳棒上的红色物质是,无水硫酸铜的作用是;
②d中反应的离子方程式是;
③装置b中发生反应的化学方程式是。
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为。
⑤阴极上产生白色物质的物质的量是;若装置b冷却时不继续通H2,则计算所得CuCl的产率会(偏大、偏小、不变)。
(1)氨在国民经济中占有重要地位。
工业合成氨的反应原理为:N2(g)+ 3H2(g) 2NH3(g)△H="―92.4" kJ·mol-1。
2NH3(g)△H="―92.4" kJ·mol-1。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q184.8 kJ(填“>”、“<”或“=”)。
②已知:
1mol N—H键断裂吸收的能量为kJ。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(H2)=mol·L-1·min-1,该温度下反应的平衡常数K =。欲增大氮气的平衡转化率,可采取的措施有(写一种措施即可)。
(2)某课外小组用下图所示装置对电解原理进行实验探究。用下图所示装置进行实验。实验过程中,两极均有气体产生,Y极区产生氧气,同时Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。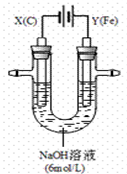
① 电解过程中,X极区溶液的pH(填“增大”、“减小”或“不变”)。
② 电解过程中,Y极发生的两个电极反应为Fe-6e-+8OH-="=" FeO42-+4H2O和。
③ 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少g。
④在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2,该电池正极发生的反应的电极反应式为。
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)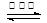 2CO2(g)+N2(g) ΔH =" a" kJ·mol-1
2CO2(g)+N2(g) ΔH =" a" kJ·mol-1
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一定容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0)。
| 时间 (s) |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/10-4mol/L |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
| c(CO)/10-3mol/L |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
回答下列问题:
(1)在上述条件下该反应能自发进行,则正反应必然是_______反应(填“放热”或“吸热”)。
(2)前3s内的平均反应速率υ(N2)=______________,t1℃时该反应的平衡常数K=____________。
(3)t1℃时向一恒压容器中冲入1molNO和1molCO,达到平衡时测得NO的物质的量为0.2mol,则此时容器的体积V=" ________" L。
(4)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是_____。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积