化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J为常见气态单质。其余为化合物,其中I、F在常温下为液态, C为臭鸡蛋气味气体,D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)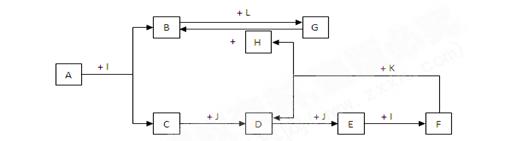
(1)写出H的电子式
(2)写出下列物质的化学式: E J
(3)写出下列变化的化学方程式:
A + I → B + C
F的浓溶液与K加热可生成D和H
(4)写出下列变化的离子方程式:
B中加入L的水溶液
G的水溶液中通入过量的H
下列烷烃的命名是否正确?若有错误加以改正,把正确的名称填在横线上: (1)CH3—CH—CH2—CH3 2—乙基丁烷
(1)CH3—CH—CH2—CH3 2—乙基丁烷 CH2
CH2
CH3
 (2)CH3—CH—CH—CH3 3,4—二甲基戊烷
(2)CH3—CH—CH—CH3 3,4—二甲基戊烷 CH3 CH2
CH3 CH2
CH3
 CH3—CH2—CH2CH2—CH3
CH3—CH2—CH2CH2—CH3
 (3)CH3—CH2—C—CH—CH—CH3 5—甲基—4,6三乙基庚烷
(3)CH3—CH2—C—CH—CH—CH3 5—甲基—4,6三乙基庚烷 CH2 CH3
CH2 CH3
CH3
用金属钠制取 通常采用下法:
通常采用下法: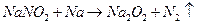 ,试说明不采用钠在氧气中燃烧而用此法制取
,试说明不采用钠在氧气中燃烧而用此法制取 的原因:
的原因:
试样x由氧化亚铁和氧化铜组成.取质量相等的两份试样,按下图所示进行实验.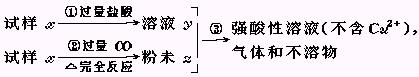
(1)请写出步骤③中所发生的全部反应的离子方程式.
(2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为 (用m表示).
在三个密闭容器内分别装有:A.Na2O2和NaHCO3,B.Na2O2和NH4HCO3,C.Na2O2和Ca(HCO3)2,其中每种物质均为1 mol。将它们加热至300℃,经充分反应后排出气体,写出各容器内残留的固体物质名称及其物质的量。A ,B ,C ,如分别加入相同浓度的足量稀H2SO4与残留物完全反应,则消耗硫酸的体积从大到小的顺序依次为 。
苏打和小苏打有着广泛应用,试从反应物用量角度说明,在下列用途中选(A)苏打,还是(B)小苏打,并说明原因。
(1)做面条时防止面粉较长时间储存变酸味,常加入适量的碱面,选用________,因为________。
(2)作为泡沫灭火器的药品,选用________,因为________。
(3)用于洗涤餐具及实验室的玻璃仪器等,选用________,因为________(提示:二者水溶液均显碱性,且苏打的碱性强)。
(4)治疗胃酸过多时,选用________,因为________。