次磷酸()是一种精细化工产品,具有较强还原性,回答下列问题:
(1)是一元中强酸,写出其电离方程式:
(2)及)均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①()中,磷元素的化合价为
②利用()进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为:(填化学式)
③是正盐还是酸式盐? 其溶液显 性(填弱酸性、中性、或者弱碱性)
(3)()的工业制法是:将白磷()与氢氧化钡溶液反应生成气体和,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式:
(4)()也可以通过电解的方法制备。工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式
②分析产品室可得到的原因
③早期采用"三室电渗析法"制备,将"四室电渗析法"中阳极室的稀硫酸用稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是 杂质。该杂质产生的原因是:
某实验室的废液中可能含有CuSO4、H2SO4、Na2SO4、NaCl、NaOH、Na2CO3和Ba(NO3)2中的一种或几种。某同学对其进行如下实验:
① 取少许废液观察,为无色透明溶液
②向所取废液中滴加氯化钡溶液,有白色沉淀产生,再加入过量稀硝酸,无明显现象
③另取废液少许,向其中加入铁粉后,产生大量气泡
根据以上现象可推断:废液中肯定含有,肯定不含不能确定是否含有。
如下图所示,在一烧杯中盛有100mlH2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央。向该烧杯里缓缓注入Ba(OH)2溶液至恰好完全反应,在此过程中:
(1)烧杯里观察到的实验现象有:
① _______________________________________
② _______________________________________
(2)写出实验过程中反应的离子方程式: _______________________________
_______________________________
(1)在盛有2mLFeCl3溶液的试管中加入足量铁粉,充分反应后,溶液由________色变为_________色,化学反应方程式为____________________________。
(2)再滴入2滴KSCN溶液,溶液颜色_______________;再加入几滴氯水,观察溶液颜色变为_________,说明_____________________,反应方程式为 ____________________
实验室中所用少量氯气是用下列方法制取的,
4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题:
(1)该反应是氧化还原反应吗?,如果是氧化还原反应,请指出___是氧化剂,是还原剂,_________是氧化产物,________是还原产物,根据上述氧化还原反应式判断氧化性:______﹥_______;还原性:______﹥_______。
⑵写出该反应的离子方程式_________
⑶用双线桥法标出该反应电子转移的方向和数目 _______________________________
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积均为VL。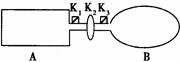
(已知:2NO2 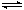 N2O4;△H<0。忽略气球材料对平衡移动的影响 )
N2O4;△H<0。忽略气球材料对平衡移动的影响 )
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A) v(B)。(填“>”、“<”、“=”);若打开活塞K2,气球B将(填:变大、变小、不变)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将(填增大或减小、不变,下同);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将,B中NO2的转化率将。