A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积均为VL。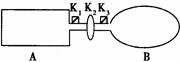
(已知:2NO2 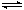 N2O4;△H<0。忽略气球材料对平衡移动的影响 )
N2O4;△H<0。忽略气球材料对平衡移动的影响 )
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A) v(B)。(填“>”、“<”、“=”);若打开活塞K2,气球B将 (填:变大、变小、不变)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将 (填增大或减小、不变,下同);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 ,B中NO2的转化率将 。
(1)蕴藏在海底的“可燃冰”是在高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。将“可燃冰”从海底取出时易融化,释放出的甲烷气体将泄漏于大气中而产生严重的环境问题,这是目前开采“可燃冰”遇到的技术难题,请据此回答:
①甲烷气体泄漏于大气中会造成怎样的环境问题?答: 。
②请你运用所学的物质结构知识解释“可燃冰”为何易融化放出气体?
答: 。
(2)设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近有人设计了一种燃料电池,一个电极通入空气,另一个电极通入液化石油气(以C4H10表示),电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。
①已知该电池的负极反应为:C4H10+13O2--26e-4CO2+5H2O,则该电池的正极反应式为 ,电池工作时,固体电解里的O2-向极移动。
②液化石油气燃料电池最大的障碍是氧化还原不完全而产生的 (填写物质的名称)堵塞电极的通气管道。
(3)能源的紧缺在很大程度上制约了我国的经济发展,请你提出解决能源紧缺问题的两点建议:① ,
② 。
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否象H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 。
(2)实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
(二)实验探究
该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
(1)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是 。
(2)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,是一种碱性氧化物,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A。冷却后称量,A的质量为72 g。据此可推得A为 ,由此得到的结论是 。
(A)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3—也被称为类卤离子。用酸与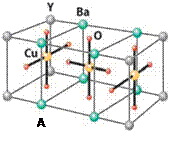
叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼
金属,如溶解铜生成CuCl2—。铜和铂的化合物在超导和医药上有重要应用,
Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2
的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试
回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为。
(3)HN3属于晶体,N3—的空间构型是_____,与N3—互为等电子体的分子的化学式为(写1种)。NH2—的电子式为,其中心原子的杂化类型是。
(4)CuCl2—中的键型为,超导氧化物A的化学式为
(5)治癌药物B的结构简式为
(B)以下是以绿矾、碳酸氢铵和氯化钾为原料制备生产市场较紧俏的硫酸钾产品的新工艺 。已知:反应(Ⅰ)的化学方程式为:FeSO4•7H2O+2NH4HCO3= FeCO3↓+(NH4)2SO4+CO2↑+H2O
反应(Ⅱ)的化学方程式为:(NH4)2SO4+2KC1=K2SO4+ 2NH4Cl
工艺流程如下: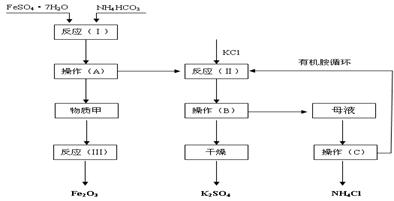
试回答下列问题:
(1)该工艺中的副产品是。(填化学式)
(2)操作C的名称为。
(3)原料绿矾、碳酸氢铵的最佳投料比是(质量比)时,FeSO4的转化率大于95%。
(4)物质甲是(填化学式),反应(Ⅲ)是甲物质与适量空气煅烧,温度为700~800℃,煅烧时间为1~1.5 h时可获得符合国标一级品要求的氧化铁红,其化学方程式是__________。
1,3-丙二醇是生产新型高分子材料PTT的主要原料,目前1,3-丙二醇的生产的路线有:以石油裂解气为原料的两条石化合成路线和一条生物工程法合成路线。
【路线1】丙烯醛水合氢化法: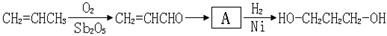
【路线2】环氧乙烷甲酰化法: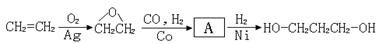
【路线3】生物发酵法:
(1)A的结构简式为。
(2)从合成原料来源的角度看,你认为最具有发展前景的路线是(填1、2或3),理由是。
(3)以1,3-丙二醇与对苯二甲酸为原料可以合成聚酯PTT,写出其化学方程式。
(4)已知丙二酸二乙酯能发生以下反应: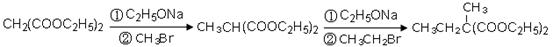
 利用该反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇为原料合成
利用该反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇为原料合成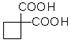 ,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
风靡全球的饮料果醋中含有苹果酸(MLA),其分子式为C4H6O5。0.1 mol苹果酸与足量NaHCO3溶液反应能产生4.48 L CO2(标准状况),苹果酸脱水能生成使溴水褪色的产物。苹果酸经聚合生成聚苹果酸(PMLA)。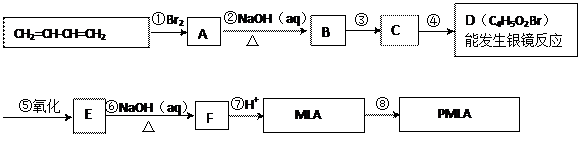
(1)写出下列物质的结构简式:A,D。
(2)指出反应类型:①②。
(3)写出所有与MLA具有相同官能团的同分异构体的结构简式:。
(4)写出E→F转化的化学方程式。
(5)上述转化关系中步骤③和④的顺序能否颠倒?(填“能”或“不能”)说明理由:。
(6)PMLA具有良好的生物相容性,可望作为手术缝合线等材料应用于生物医药和生物材料领域。其在生物体内水解的化学方程式为。