对于可逆反应:m A(g) + n B(g) x C(g),在不同温度及压强(p1, p2)条件下,反应物A的转化率如图所示,下列判断正确的是
x C(g),在不同温度及压强(p1, p2)条件下,反应物A的转化率如图所示,下列判断正确的是 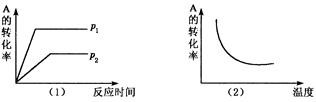
| A.△H > 0, m + n > x | B.△H > 0, m + n < x |
| C.△H < 0, m + n < x | D.△H < 0, m + n > x |
下列说法中,正确的是
| A.Na2O和Na2O2组成元素相同,且都能与硫酸溶液反应 |
| B.光导纤维由SiO2制备得到,其属于硅酸盐产品 |
| C.工业上利用电解熔融的MgO来制备镁 |
| D.SO2通入新制氯水中,氯水褪色是因为SO2具有漂白性 |
分类是科学研究的重要方法,下列物质分类不正确的是
| A.非电解质:乙醇,氯气,葡萄糖 |
| B.化合物:冰水混合物,烧碱,小苏打 |
| C.分子晶体:干冰,碘单质,蔗糖 |
| D.混合物:铝热剂,纯净矿泉水,分析纯盐酸 |
下列表示物质结构的化学用语或模型图正确的是
A.H2O2的电子式: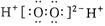 |
B.O2-的结构示意图: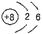 |
| C.二氧化硅的分子式:SiO2 |
D.质子数为8,中子数为10的氧原子: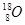 |
设NA是阿伏加德罗常数的数值,下列说法正确的是
| A.1molAl3+离子含有的核外电子数为3NA |
| B.12g金刚石中含有的共价键数为4NA |
| C.46gNO2和N2O4混合气体中含有原子总数为3NA |
| D.标准状况时1LpH=13的NaOH溶液中含有的OH-离子数为0.1NA |
1950年被丹麦的科学家延斯·斯科(Jens Skou)发现,钠钾泵可以将细胞外相对细胞内较低浓度的钾离子送进细胞,并将细胞内相对细胞外较低浓度的钠离子送出细胞。经由以具放射性的钠、钾离子标定,可以发现钠、钾离子都会经过这个通道,钠、钾离子的浓度在细胞膜两侧也都是相互依赖的,所以显示了钠、钾离子都可以经过这个载体运输。目前已知钠钾泵需消耗ATP,并可以将三个钠离子送出细胞,同时将两个钾离子送进细胞。下列关于钠、钾的说法正确的是
| A.单质钠的原子半径比钾的原子半径大 |
| B.Na+和K+常用作氧化剂 |
| C.钠和钾都是短周期第ⅠA元素 |
| D.钠和钾的合金[ω(K)=50%~80%]在室温下呈液态 |