下列叙述正确的是
| A.电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 |
| B.在铁上镀锌时,锌棒作阳极,且电解液硫酸锌的浓度是不变的 |
| C.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1: 2 |
| D.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH |
【3分】金属钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法制取TiO2,再由TiO2制取金属Ti。由TiO2制取金属Ti的反应为:①TiO2+2C+2Cl2 TiCl4+2CO②TiCl4+2Mg
TiCl4+2CO②TiCl4+2Mg 2MgCl2+Ti则下列叙述正确的是( )
2MgCl2+Ti则下列叙述正确的是( )
| A.由反应①可知,Cl2是氧化剂,TiCl4是氧化产物 |
| B.由反应①可知,可用CO在高温下把TiO2还原成Ti |
| C.由反应②可知,若有24 g Mg参加反应,就可生成1 mol Ti |
| D.由反应②可知,金属Mg的还原性比金属Ti的还原性强 |
【3分】能正确表示下列反应的离子方程式是( )
A.碳酸氢铵溶液中加入NaOH溶液共热 |
B.用碳酸钠溶液吸收少量二氧化硫2 +SO2+H2O====2 +SO2+H2O====2 + + |
| C.FeBr2溶液中加入过量的氯水2Fe2++2 Br-+2Cl2====Br2+4 Cl-+2Fe3+ |
D.硫酸镁溶液和氢氧化钡溶液反应 +Ba2+====BaSO4↓ +Ba2+====BaSO4↓ |
【3分】某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解,)且 的物质的量浓度为6 moL·L-1,则此溶液最多可溶解铁粉的质量为( )
的物质的量浓度为6 moL·L-1,则此溶液最多可溶解铁粉的质量为( )
| A.11.2 g | B.16.8 g | C.19.6 g | D.22.4 g |
【3分】已知某溶液中存在较多的H+、 、
、 ,则在该溶液中不能大量存在的离子组是( )
,则在该溶液中不能大量存在的离子组是( )
①K+、 、F- ②K+、Ba2+、Cl- ③Fe2+、Cl-、Br- ④K+、Na+、ClO-
、F- ②K+、Ba2+、Cl- ③Fe2+、Cl-、Br- ④K+、Na+、ClO-
| A.①②③④ | B.只有②③④ |
| C.只有①③④ | D.只有②③ |
【3分】下列反应的现象描述与离子方程式都正确的是( )
| A.金属镁与稀盐酸反应:有氢气产生Mg+2H++2Cl-====MgCl2+H2↑ |
B.氯化钡溶液与硫酸反应:有白色沉淀生成Ba2++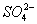 ====BaSO4↓ ====BaSO4↓ |
| C.碳酸钠溶液与盐酸反应:有气泡逸出Na2CO3+2H+====2Na++CO2↑+H2O |
| D.过量铁粉与氯化铁溶液反应:溶液变浅绿色Fe+Fe3+====2Fe2+ |