甲醇是一种优质燃料,可制作燃料电池。
(1)工业上可用下列两种反应制备甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
已知:2H2(g)+ O2(g) = 2H2O(g) ΔH3。则2CO(g)+O2(g) = 2CO2(g) 的反应热
ΔH=_____________(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
(3)某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、减小、不变)。负极的电极反应式为_______ ______。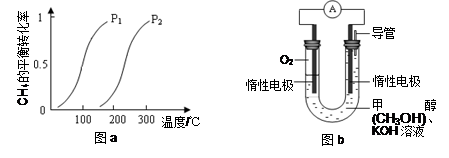
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ;
阳极泥为:
(1)按系统命名法,有机物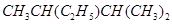 的名称是 。若该有机物是由烯烃加成氢气得来的,那么烯烃的结构有种,若该有机物是由炔烃加成氢气得来的,那么炔烃的结构简式该炔烃与含等物质的量的溴的四氯化碳反应的方程式为
的名称是 。若该有机物是由烯烃加成氢气得来的,那么烯烃的结构有种,若该有机物是由炔烃加成氢气得来的,那么炔烃的结构简式该炔烃与含等物质的量的溴的四氯化碳反应的方程式为
(2)支链只有一个乙基且式量最小的烷烃 的结构简式
氯化钠样品含有少量的Na2SO4和 Na2CO3,按下列流程进行净化,请在流程中的()中写上合适的试剂,在[ ]中写上实验操作名称
写出有关反应的化学方程式:
第步②
第步③
第步⑤
已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器。)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。
| 序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
| ① |
溶解 |
将混合物放入烧杯中,加入98% H2SO4,充分搅拌直到固体不再溶解。 |
| ② |
||
| ③ |
||
| ④ |
||
| ⑤ |
洗涤沉淀 |
|
| ⑥ |
检验沉淀 是否洗净 |
下列提纯方法不正确的是
| A.除去KNO3中的NaCl杂质-----------结晶.重结晶 |
| B.除去食盐中的泥沙-----------过滤 |
| C.除去KCl中的K2CO3------------加适量盐酸 |
| D.除去碘水中的水-----------升华 |
(06年上海化学26)某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如下图装置。倾斜A使稀硫酸(足量)与固体 M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为V mL(已折算成标准状况)由上述实验事实可知: 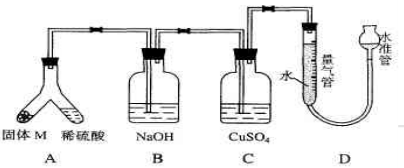
(1)①固体M中一定有的物质是_____(填化学式)理由是_____。②其中一种物质的质量可以确定为____g(用代数式表示)。
(2)B装置的名称是_____。写出B装置中反应的离子方程式_____。
(3)C装置的作用是_____,如果实验中没有B装置,则C装置中产生的现象是__________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是__________
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥