有一未知浓度的食醋,某学生为测定CH3COOH的浓度在实验室中进行如下实验。请完成下列填空:
(1)配制100 mL 0.10 mol·L-1NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后)________→洗涤(并将洗涤液移入容量瓶)→________→________→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量0.4 g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、________、________。
(2)取20.00 mL待测食醋放入锥形瓶中,由于食醋颜色较深,我们先____________________________________,并滴加2~3滴________做指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验 编号 |
NaOH溶液的浓度/(mol·L-1) |
滴定完成时,NaOH溶液滴入的体积/mL |
待测CH3COOH溶液的体积/mL |
| 1 |
0.10 |
22.62 |
20.00 |
| 2 |
0.10 |
22.72 |
20.00 |
| 3 |
0.10 |
22.80 |
20.00 |
①滴定达到终点的标志是
________________________________________________________________________。
②根据上述数据,可计算出该食醋中CH3COOH的浓度约为________(保留两位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________。
A.滴定终点时俯视读数
B.移液管水洗后未用食醋溶液润洗
C.锥形瓶水洗后未干燥
D.称量前NaOH固体中混有Na2CO3固体
E.配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F.碱式滴定管尖嘴部分有气泡,滴定后消失
【改编】部分中学化学常见元素原子结构及性质如表所示:
| 序号 |
元素 |
结构及性质 |
| ① |
A |
A单质是中学化学常见金属,在空气中燃烧生成淡黄色固体 |
| ② |
B |
B与A在同一周期,电子层数等于最外层电子数 |
| ③ |
C |
C是常见化肥的主要元素,单质常温下呈气态 |
| ④ |
D |
D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ |
E |
通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ |
F |
F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A原子在周期表中的位置为________。
(2)B与E形成的化合物的化学式为______,它属于_____化合物(填“酸性”或“碱性”或“两性”)。
(3)F与E可以形成10电子和18电子的两种化合物X和Y,区别X与Y的水溶液的实验方法是__________________________________________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱____________。
(5)A和B的最高价氧化物对应的水化物之间反应的离子方程式为:_________________________。
某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)该反应的化学方程式为_________________________________________。
(2)反应开始至4 min时,A的平均反应速率为________________________________。
(3)4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
(10分)短周期元素A、B、C、D、E原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙;D与A位于同一主族;在同周期元素形成的简单离子中,E的离子半径最小。
(1)实验室中可用A2C2制取C单质,其化学方程式是
(2)由A、C、D三种元素组成的化合物的电子式是 ;B、C、E三种元素组成的常见盐的水溶液呈酸性,原因是 (用离子方程式表示)。
(3)反应乙+C2→B2+A2C(未配平)可设计为燃料电池,则通入乙的电极是 (填“正”或“负”)极,在碱性条件下其电极反应是
将纯锌片和纯铜片按下图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题: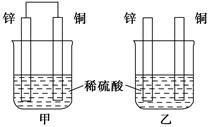
(1)下列说法中正确的是__________(填序号)。
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中H+的浓度均减小 |
(2)在相同时间内,两烧杯中产生气泡的速率:甲____乙(填“>”、“<”或“=”)。
(3)当甲中产生1.12 L(标准状况)气体时,理论上通过导线的电子数目为__________。
(4)当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1。试确定原稀硫酸的物质的量浓度为______________。
【原创】针对下面9种元素,完成以下各小题
(1)单质为有色气体的元素是___________(填名称)。
| 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(2)③与④⑤简单离子的半径由大到小的顺序为___________(填元素符号)。
(3)元素②的单质的电子式为__________。
(4)最高价氧化物对应的水化物酸性最强的是___________________。(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为___________。
(6)⑦的单质的用途正确的是___________。
A.光导纤维B.太阳能电池C.普通玻璃D.计算机芯片
(7)元素①和⑦非金属性较强的是____,写出一个能表示二者非金属性强弱关系的化学方程式为:__________。