药物G是一种抗精神病药物,一种工业合成G的路线如下:
(1)有机物B中含氧官能团有 、 及羟基(填官能团名称)。
(2)写出反应类型,B→C ;C→D 。
(3)X的分子式为:C10H13N2Cl,则X的结构简式为 。
(4)设计步骤A→B的目的是: 。
(5)写出同时满足下列条件的C的一种同分异构体的结构简式 。
①苯的衍生物,含有两个互为对位的取代基;
②能发生水解反应,产物之一是甘氨酸,另一种产物能与FeCl3溶液发生显色反应;
③分子中有手性碳原子

【化学—选修3物质结构与性质】前四周期原子序数依次增大的五种元素A、B、C、D中,A的族序数与最外层数、周期数相等, B元素是植物生长需要的营养元素,也是空气中含量最高的元素;C元素处于第二周期且价电子层中未成对电子数为2,D元素周期表中ds区元素且最外电子层上只排布了一个电子。
回答下列问题:
(1)A、B、C三种元素中第一电离能由小到大的顺序是 ,(填元素符号)
(2)A、B两种元素形成的化合物B2A4是一种高能燃料,在工业生产中用途广泛。写出其电子式 ,该化合物的类型是_______(填离子化合物、共价化合物)。
(3)发射火箭时,常以B2A4为燃料,用双氧水作氧化剂,两者反应生成无毒、无害的气体。已知3.2g液态N2H4在上述反应中放出128.44kJ的热量,则该反应的热化学方程式:_______。
(4)①D2+的价层电子排布图为 。
②胆矾CuSO4·5H2O可写成[Cu(H2O) 4]SO4·H2O,其结构示意图如下: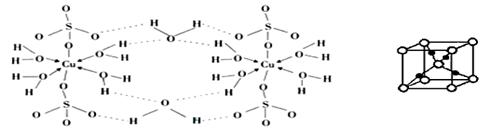
在胆矾中含有的粒子间作用力是 (填序号)。
a.离子键
b.极性键
c.金属键
d.配位键
e.氢键
f.非极性键
③在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,指出1molCN-中p键的数目为 。胆矾受热分解得到铜的某种氧化物,其晶胞结构如上图所示,则氧的配位数是 。
【化学—选修2化学与技术】聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下: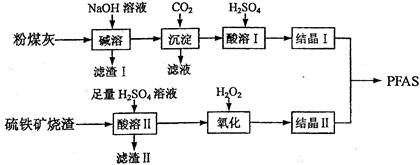
(1)水是生命之源,水质优劣直接影响人体健康. 天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称),其净水作用的原理是 。水的净化与软化的区别是 。
(2)“碱溶”时,发生反应的化学方程式为 。“滤渣Ⅰ”成分是_________。
(3)“酸溶Ⅱ”时,可以产生Fe2+的反应的离子方程式为 。
(4)“氧化”时应控制在比较低的温度下进行,原因是 。
(5)“氧化”时若用ClO2代替,发生反应的离子方程式是 。
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:①Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g)ΔH1=+489.0 kJ/mol,
②C(s)+CO2(g)=2CO(g)ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)①分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。则该电池的负极反应式: 。
②用上述燃料电池用惰性电极电解足量MgCl2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
(3)一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
①该反应的平衡常数表达式K= 。
②一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示。8分钟内,CO的平均反应速率v(CO)= mol/(L·min)。
③下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
| A.升高温度 | B.增大压强 |
| C.充入一定量CO | D.再加入一些铁粉 |
④CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图:
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图:
(i)曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
(ii)一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂
选考【化学——选修3物质结构与性质】由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态Cu+ 的核外电子排布式为 。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因: 。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于 晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过如下反应制得:
3CH4 + 2 (HB=NH)3 + 6H2O →3CO2 + 6H3BNH3
与上述化学方程式有关的叙述不正确的是 。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
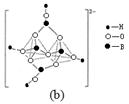
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为 。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为 。
(5)CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
运用化学反应原理研究碳的化合物具有重要意义。
(1)常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s) 5CO2(g)+I2(s) △H<0。向2L密闭容器中加入足量I2O5(s),并通人1molCO,CO2的体积分数
5CO2(g)+I2(s) △H<0。向2L密闭容器中加入足量I2O5(s),并通人1molCO,CO2的体积分数 随时间的变化如下图所示:
随时间的变化如下图所示:
①0~0.5min内的平均反应速率v(CO)= _____________。
②保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是______。
a.生成I2的质量为原来的2倍
b.混合气体的平均摩尔质量不变
c.达到平衡的时间为原来的2倍
d.混合气体的密度不变
③反应达a点时,欲增大容器中CO2的体积分数 ,可采取的措施为____________。
,可采取的措施为____________。
(2)以 为催化剂,可以将
为催化剂,可以将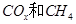 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。
①若该反应的原子利用率为100%,则 ______________。
______________。
②在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则: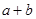 _____14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
_____14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)利用反应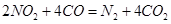 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。