I、为减少温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2。
(1)若有1mol CH4生成,则有 molσ键和 molπ键断裂。
(2)CH4失去H—(氢负离子)形成CH+3(甲基正离子)。已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为 。
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁)。形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18。
(3)金属羰基配合物中,微粒间作用力有 (填字母代号)
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃。由此推测,固体羰基铁更接近于 (填晶体类型)。若用Fe(CO)x表示羰基铁的化学式,则x= 。
III.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定。
(5)预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释。
答:HgCl42-比HgI42-更 (填“稳定”或“不稳定”),因为 。
分子式为C2H6O的化合物A具有如下性质:
A+Na 慢慢产生气泡
慢慢产生气泡
A+CH3COOH 有香味的产物
有香味的产物
(1)根据上述信息,对该化合物可作出的判断是______________。
| A.一定含有—OH | B.一定含有—COOH |
| C.A为乙醇 | D.A为乙醛 |
(2)含A的体积分数为75%的水溶液可以用作_______________。
(3)A与钠反应的化学方程式为_______________________________________________。
(4)化合物A和CH3COOH反应生成的有香味的产物的结构简式为___________。
(1)已知化合物B3N3H6(硼氮烷)与C6H6(苯)的分子结构相似,如下所示,则硼氮烷的二氯取代物B3N3H4Cl2的同分异构体数目为______________。
| A.2 | B.3 | C.4 | D.6 |
(2)某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成G,G能使紫色石蕊溶液变红,已知:
①化合物A和G的结构简式A:___________、G:___________。
②与G同类的同分异构体(含G)有___________种。
(3)某高聚物的结构如下:
合成该高聚物分子的结构简式为: ______________________、______________________。
某温度下0.1 mol·L-1Na2CO3溶液中,c(Na+)/c(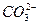 )=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(
)=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(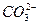 )=5/2>20/9,其原因是_________,此时c(
)=5/2>20/9,其原因是_________,此时c( )=_________。
)=_________。
现有电解质溶液:①Na2CO3②NaHCO3
③NaAlO2④CH3COONa⑤NaOH。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是__________(填编号)。
(2)将上述物质的量浓度均为0.1 mol·L-1的五种溶液,稀释相同倍数时,pH变化最大的是__________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是__________(填编号)。
(4)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为__________。
我国能源以煤为主,燃煤产生的二氧化硫的年排放量为1825吨,居世界首位。二氧化硫在湿度较大的大气中,在烟尘中的金属离子作用下会发生催化氧化反应,形成酸雾,其化学方程式是__________________________________________________________。