根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是____,在元素周期表中的位置是____________________。
(2)C元素基态原子的电子排布图是下图中的_______(填序号),另一电子排布图不能作为基态原子的电子排布图是因为它不符合_______(从A B C中选择)。
A.能量最低原理 B.泡利原理 C.洪特规则
(3)依据正负化合价代数和等于0,H元素可以放在周期表中的 族
(4)氯化铵的电子式
牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸,乳酸的结构简式为 。已知有机物中若含有相同的官能团,则化学性质相似。完成下列问题:
。已知有机物中若含有相同的官能团,则化学性质相似。完成下列问题:
(1)写出乳酸分子中官能团的名称。
(2)一定条件下乳酸能发生的反应类型有______________ (填序号)。
| A.水解反应 |
| B.取代反应 |
| C.加成反应 |
| D.中和反应 |
E.氧化反应
F.酯化反应
(3)写出过量乳酸与碳酸钠溶液反应的化学方程式。
(4)乳酸在浓硫酸作用下,两分子相互反应生成链状结构的物质,写出此有机生成物的结构简式_____。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: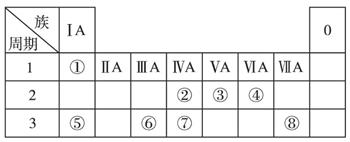
(1)在以上元素的原子中,形成化合物种类最多的是(填元素符号)。
(2)地壳中含量居于第二位的元素在周期表中的位置是。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式、。
(4)W是第五周期与④同主族的元素。据此推测W不可能具有的性质是。
| A.最高正化合价为+6价 |
| B.气态氢化物比H2S稳定 |
| C.最高价氧化物的水化物的酸性比硫酸弱 |
| D.单质在常温下可与氢气化合 |
(5)由元素⑥、⑧形成的物质X与由元素①、③形成的化合物Y可发生以下反应: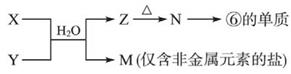
X溶液与Y溶液反应的离子方程式,M中阳离子的鉴定方法。
根据化学反应与能量转化的相关知识,试回答下列问题:
(1)已知:白磷 黑磷,黑磷比白磷稳定,结构与石墨相似,下图能正确表示该反应中能量变化的是________(填序号)。
黑磷,黑磷比白磷稳定,结构与石墨相似,下图能正确表示该反应中能量变化的是________(填序号)。
(2)已知:在25 ℃、101 kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15 kJ,则CH4燃烧的热化学方程式是。
(3)已知:氢氧燃料电池的总反应方程式为2H2+O2==2H2O。其中,氢气在(填“正”或“负”)极反应,在碱性条件下,电极反应式为 。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
在2SO2+O2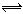 2SO3的反应里,开始SO2和O2的浓度均为0.5mol·L-1,2分钟后测得SO2的浓度为0.25mol·L-1,则v(O2)=________________,各物质所表示的反应速率的最简整数比v(SO2):v(SO3):v(O2)=。
2SO3的反应里,开始SO2和O2的浓度均为0.5mol·L-1,2分钟后测得SO2的浓度为0.25mol·L-1,则v(O2)=________________,各物质所表示的反应速率的最简整数比v(SO2):v(SO3):v(O2)=。
有机物A是一种纯净的无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A物质 18.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为_ _ |
(2)A的核磁共振氢谱如图: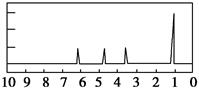 |
(2)A中含有_____种氢原子 |
| (3)另取A 18.0 g与足量的NaHCO3粉末反应,生成0.2 mol CO2,若与足量钠反应则生成0.2 mol H2。 |
(3)写出一个A分子中所含官能团的名称和数量___ |
| (4)将此18.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者依次增重10.8 g和26.4 g。 |
(4)A的分子式为____ |
| (5)综上所述A的结构简式____ ___。 |