对下列实验现象的原因分析不正确的一项是 ( )
| 选项 |
实验现象 |
原因分析 |
| A |
浓硫化钠溶液有臭味 |
硫 硫离子水解生成硫化氢,硫化氢具有臭味 |
| B |
新新制氯水中滴加石蕊试液,溶液先变红,后褪色 |
氯气与水反应生成HCl、HClO,HCl显强酸性,使石蕊变红,HClO具有强氧化性,使其褪色 |
| C |
SO 2通入溴水中,溴水褪色 |
SO 2具有漂白性,使其褪色 |
| D |
向向饱和Na2CO3溶液中通入足量CO2气体,溶液变浑浊 |
析析出了NaHCO3晶体 |
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1 kJ,破坏1mol氯气中的化学键消耗的能量为Q2 kJ,形成1mol氯化氢中的化学键释放的能量为Q3 kJ。下列 关系式中,正确的是
关系式中,正确的是 ()
()
| A.Q1 + Q2> Q3 | B.Q1 + Q2> 2Q3 |
| C.Q1 + Q2< 2Q3 | D.Q1 + Q2< Q3 |
下列有机物在空气中燃烧 ,产生明亮并带有浓烟火焰的物质是()
,产生明亮并带有浓烟火焰的物质是()
| A.CH4 | B.CH2=CH2 | C.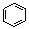 |
D.CH3CH2OH |
随着人们生活质量的不断提高,废旧电池必须进行集中处理的问题被提到了政府的议事日程,其主要原因是()
| A.回收废旧电池中的石墨电极材料 |
| B.防止电池中汞、镉和铅等重金属元素对土壤和水源的污染 |
| C.防止废旧电池中渗漏的电解液腐蚀其他物品 |
| D.回收废旧电池外壳的金属材料 |
下列有关原电池的叙述中正确的是()
| A.把电能转变为化学能的装置 |
| B.活泼金属做正极,不活泼金属或非金属做负极 |
C. 外电路中电子从负极流向正极 外电路中电子从负极流向正极 |
| D.正极发生氧化反应 |
下列物质分别溶于水中,能使溶液温度显著升高的是()
| A.浓硫酸 | B.食盐 | C.酒精 | D.氯化铵 |