为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:电池:Pb(s)+ PbO2(s)+2H2SO4(aq)= 2PbSO4(s)+ 2H2O(l)
电解池:2Al + 3H2O  Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
| |
原电池 |
电解池 |
| A |
H+移向Pb电极 |
H+移向Pb电极 |
| B |
每消耗3molPb |
生成2molAl2O3 |
| C |
正极:PbO2+4H++2e-=Pb2++2H2O |
阳极:2Al+3H2O-6e-=Al2O3+6H+ |
| D |
 |
 |
2010年上海世博会实现了环保世博、生态世博的目标,下列做法中不符合这一目标的是
| A.部分国家的展馆使用可降解的建筑材料 |
| B.把世博会期间产生的垃圾焚烧或深埋处理 |
| C.某些馆的外壳使用非晶硅薄膜,以充分利用太阳能 |
| D.停车场安装了催化光解设施,用于处理汽车尾气 |
下列表述Ⅰ和Ⅱ都正确,且存在因果关系的是
| 表述Ⅰ(因) |
表述Ⅱ(果) |
|
| A |
Si元素位于周期表金属和非金属交界线 |
Si为非金属元素,其单质是半导体,可做光导纤维的材料 |
| B |
“硅胶”是硅酸钠的冻状凝胶经脱水后得到的,多孔、吸附水分能力强 |
硅胶常用作实验室和袋装食品、瓶装药品等的干燥剂 |
| C |
打磨过的铝箔在空气中其表面会很快生成Al2O3薄膜,而且Al2O3的熔点高于Al |
打磨过的铝箔在空气中燃烧会失去光泽但熔化的铝并不滴落 |
| D |
Fe2O3难溶于水 |
Fe(OH)3不能通过化合反应直接制得 |
下列推断正确的是
| A.等质量的NaHCO3和Na2CO3固体中,分别加入足量盐酸,NaHCO3产生的气体多 |
| B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
| C.乙醇与金属钠的反应比水与金属钠的反应平缓得多,说明乙醇羟基中的氢原子比水分子中的氢原子活泼 |
| D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液最终呈红色 |
关于下列装置说法正确的是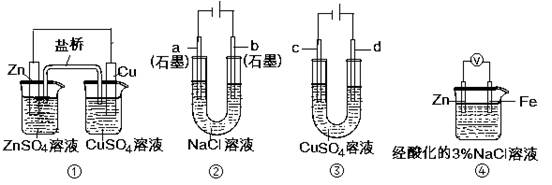
| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.装置②工作一段时间后,a极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
下列叙述中正确的是
| A.将苯加入浓溴水中,溴水褪色,是因为发生了取代反应 |
| B.Na2CO3溶液可以用来鉴别乙酸、乙醇和苯 |
| C.淀粉和纤维素都可以用(C6H10O5)n表示,因此他们属于同分异构体 |
| D.水煤气、焦炉气、沼气、汽油等都是混合物,而高分子化合物PVC是纯净物 |