A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):试回答: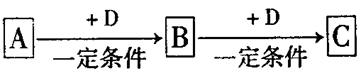
(1)若D是具有氧化性的单质,则属于主族的金属A为 ________ (填元素符号),C的电子式为__________
(2)若A是某物质的稀溶液,D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示)____________;D在潮湿的空气中易发生 吸氧腐蚀,写出腐蚀时原电池正极的电极反应式___________。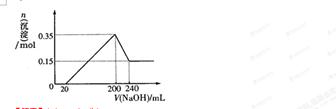
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式_____________________。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E 的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则固体混合物中Mg的质量为________;NaOH溶液的物质的量浓度为 ________。硫酸溶液的物质的量浓度为_______。
(2小题每空3分,1、3小题每空2分,共16分)已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛: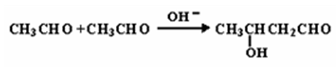
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的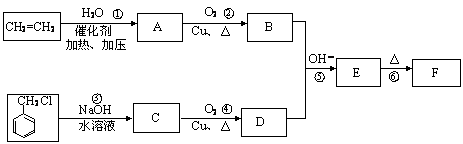
已知:反应⑥为含羟基的物质在浓硫酸催化作用下分子内脱水的反应。反应⑤为碱性条件下醛醛加成反应,请回答
(1)肉桂醛F的结构简式为: 。E中含氧官能团的名称为 。
(2)写出下列转化的化学方程式:
②_________________。
③ 。
写出有关反应的类型:① ,④ 。
(3)符合下列要求的E物质的同分异构体有 种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。
(1~4小题每空2分,5~6小题每空3分,共14分)A~G是几种烃的分子球棍模型(如图),据此回答下列问题: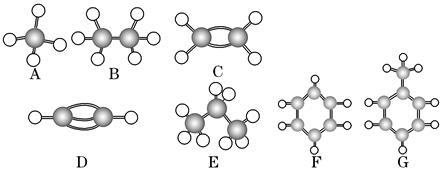
(1)常温下含碳量最高的气态烃是________(填字母)。
(2)不能够发生加成的烃有________种。
(3)一卤代物有两种的是________(填字母)。
(4)等质量的上述烃燃烧耗氧最多的是 (填字母)。
(5)写出实验室制C的化学方程式_______________。
(6)写出F发生溴代反应的化学方程式________ ____。
(1~5小题每空2分,6小题3分,共17分)
以下是实验室常用的部分仪器,请回答下列问题
(1)序号为⑥和⑩的仪器的名称分别为________、________。
(2)在过滤操作中,必须用到上述仪器中的___(填序号),次外,上图中还缺少的玻璃仪器 (填名称)。
(3)能作反应容器且可直接加热的仪器是上述中的________(填名称)。
(4)仪器上标有温度的是_______(填序号)。
(5)如图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是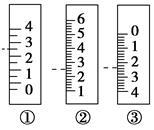
| A.①是量筒,读数为2.5 mL |
| B.②是量筒,读数为2.5 mL |
| C.③是滴定管,读数为2.5 mL |
| D.②是温度计,读数是2.5 ℃ |
(6)丙同学想用如图装置以大理石和稀盐酸反应制取CO2。教师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上述①~⑩中的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置。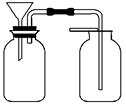
按要求填空。
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是__ ______。
(2)已知拆开1 mol H—H键、1 mol I—I分别需要吸收的能量为436 kJ、151 kJ,而形成1 mol H—I键会释放299 kJ能量。则由氢气和碘反应生成1 mol HI需要________(填“放出”或“吸收”)_______ __kJ的热量。
(3)S(g)+O2(g)=SO2(g) ΔH 1<0;S(s)+O2(g)=SO2(g) ΔH 2<0,比较ΔH1 __ ___ΔH2大小。
在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:CO2(g)+H2(g)  CO(g)+H2O(g)。
CO(g)+H2O(g)。
(1)已知在700 ℃时,该反应的平衡常数K1=0.5,则该温度下反应CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数K2=________。
CO2(g)+H2(g)的平衡常数K2=________。
(2)已知在1 000 ℃时,该反应的平衡常数K3为1.0,则该反应为__ ______反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是_________。(填编号)
| A.容器中压强不变 |
| B.c(CO2)=c(CO) |
| C.生成a mol CO2的同时消耗a mol H2 |
| D.混合气体的平均相对分子质量不变 |
(4)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正_______v逆(填“>”、“=”或“<”),该温度下反应达到平衡时,CO2的转化率为_________。