(12分)化学实验是研究物质性质的基础。
(1)下列有关实验操作或测量数据不合理的是______(填序号)。
A.用铁坩埚加热CuSO4·5H2O晶体测定结晶水质量分数
B.用干燥的pH试纸测定浓硫酸的pH
C.用规格为20 mL的量筒,量取16.8 mL的Na2CO3溶液
D.用已知浓度盐酸滴定未知浓度氨水,用酚酞做指示剂。
(2) 某废水样品中含有一定量的Na+、CO 、SO
、SO ,某研究小组欲测定其中SO
,某研究小组欲测定其中SO 的浓度。
的浓度。
实验方案:
ⅰ.用烧杯盛取废水适量,加少量活性炭,除去废水中的杂质;过滤,取滤液;
ⅱ.精确量取20.00 mL过滤后废水试样,选择使用紫色的0.1 mol·L-1 KMnO4(H2SO4酸化)溶液进行滴定;
ⅲ.记录数据,消耗KMnO4(H2SO4酸化)溶液体积Vml,计算。
①下列滴定方式中,最合理的是(夹持部分略去)________(填字母序号)。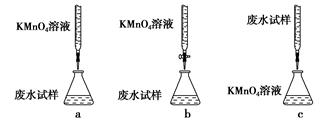
②达到滴定终点时现象是: 。SO 的浓度的表达式为: 。
的浓度的表达式为: 。
(3) 已知反应: BeCl2+Na2BeO2+2H2O =" 2" NaCl+2Be(OH)2 ↓能进行完全, 据此判断下列叙述正确的是:
A、BeCl2溶液的 pH<7, 将其蒸干灼烧后得到的残留物为 Be(OH)2
B、Na2BeO2溶液的 pH>7, 将其蒸干灼烧后得到的残留物为 BeO
C、Be(OH)2既能溶解于盐酸, 又能溶解于 NaOH 溶液
D、Na2BeO2溶液中守恒关系有:C(Na+)+ C(H+)= 2c(BeO22-)+C(OH-)+C(H2BeO2)
E 、Li 、 Be 、 B 三种元素的第一电离能异常小的 B 元素。
已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。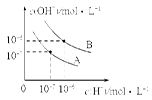
(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是________。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1________α2(填“大于”、“小于”、“等于”或“无法确定”),若二者恰好反应所得溶液的pH<7,原因是__________________。(用离子方程式表示)
(4)在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=________。
已知物质A、B、C、D、E是由短周期元素构成的单质或化合物,它们可发生如图所示的转化关系:
(1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式_____________。将气体D作为燃料电池的燃料源可以制成D—空气燃料电池系统,总反应式为:D+O2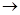 A+H2O(未配平),写出此碱性燃料电池的负极反应式:________________。
A+H2O(未配平),写出此碱性燃料电池的负极反应式:________________。
(2)若条件①为加热,E是一种两性氢氧化物,气体D是一种有臭鸡蛋气味的气体,其水溶液是还原性酸,则C为____________(写化学式)。
(3)若条件①为常温,B和D为同种无色气体,常温下E的浓溶液可以使Fe钝化,写出少量Fe粉与E的稀溶液反应的离子方程式:_________________________________。
已知常温下1molC与H2O反应生成气体D和E溶液放出46kJ热量,写出C与水反应生成D和E的热化学方程式:________________________。
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
I CaSO4(s)+ CO(g) CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ·mol-l
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ·mol-l
II CaO(s) +3CO(g)+SO2(g) CaS(s)+3CO2(g) △H2=-394.0 kJ·mol-l
CaS(s)+3CO2(g) △H2=-394.0 kJ·mol-l
(1)若用K1、K2分别表示反应I、II的化学平衡常数,则反应1/2CaSO4(s)+2CO(g) 1/2CaS(s)+2CO2(g)的平衡常数K=_________(用含K1、K2的式子表示)
1/2CaS(s)+2CO2(g)的平衡常数K=_________(用含K1、K2的式子表示)
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
| t/s |
0 |
10 |
20 |
30 |
50 |
| c(CO)mol/L |
3 |
1.8 |
1.2 |
0.9 |
0.9 |
前20 s 内v(SO2)=__________mo1·L-l·s-l,平衡时CO的转化率为__________。
(3)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量,对反应IICaO(s) +3CO(g) +SO2 (g) CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):
CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):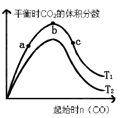
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是_______________。
②图像中T2_____T1(填“高于”、“低于”、“等于”或 “无法确定”)判断的理由是____________________。
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y单质晶体熔点高硬度大。试回答下列问题:
(1)五种元素中原子半径最大的元素是__________(写元素符号)
(2)X与M两元素以原子个数1:1形成的化合物的电子式为____________________
(3)写出由YM2制取Y单质的化学方程式____________________
(4)化合物Z 2 W 2遇水剧烈反应,产生黄色沉淀和刺激性气味的气体,其反应的化学方程式为____________
(5)W、M两元素形成的单质和化合物常用来杀菌消毒,试举例__________(写化学式,任写两种)
(12分)下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。
请回答下列问题:
(1)H中含有的化学键类型是________________________。
(2)上述框图所示的反应中,既属于化合反应,又属于氧化还原反应的反应共有______个;反应③的离子方程式____________________________。
(3)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,若在溶液变红的一极收集到0.2 g气体,则此时溶液的pH是_______(假设溶液的体积为2 L且不考虑电解后溶液体积的变化)。
(4)J溶液显_______(填“酸”、“碱”或“中”)性,原因是_________________________。(用离子方程式表示)