近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
I CaSO4(s)+ CO(g) CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ·mol-l
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ·mol-l
II CaO(s) +3CO(g)+SO2(g) CaS(s)+3CO2(g) △H2=-394.0 kJ·mol-l
CaS(s)+3CO2(g) △H2=-394.0 kJ·mol-l
(1)若用K1、K2分别表示反应I、II的化学平衡常数,则反应1/2CaSO4(s)+2CO(g) 1/2CaS(s)+2CO2(g)的平衡常数K=_________(用含K1、K2的式子表示)
1/2CaS(s)+2CO2(g)的平衡常数K=_________(用含K1、K2的式子表示)
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
| t/s |
0 |
10 |
20 |
30 |
50 |
| c(CO)mol/L |
3 |
1.8 |
1.2 |
0.9 |
0.9 |
前20 s 内v(SO2)=__________mo1·L-l·s-l,平衡时CO的转化率为__________。
(3)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量,对反应IICaO(s) +3CO(g) +SO2 (g) CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):
CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):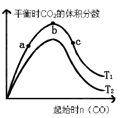
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是_______________。
②图像中T2_____T1(填“高于”、“低于”、“等于”或 “无法确定”)判断的理由是____________________。
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯.玻璃棒.量筒外,还必须有____________ (填仪器名称),操作II必须用到的仪器是______ ______(填编号)。
______(填编号)。
| A.50mL烧杯 | B.50mL量筒 |
| C.25mL碱式滴定管 | D.25mL酸式滴定管 |
(2) 洗涤是洗去附着在沉淀上的____________。(写离子符号)
洗涤是洗去附着在沉淀上的____________。(写离子符号)
(3)检验沉淀是否已经洗涤干净的操作是________________________。
(4)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是_________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是____________。
(6)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是________________________。(用化学方程式表示)
(1)要配制浓度约为2mol/L的NaOH溶液100ml,下面操作正确的是
①称取8g NaOH固体,放入250ml烧杯中,用100ml量筒量取100ml蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
②称取8g NaOH固体,放入100ml量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100ml
③称取8g NaOH固体,放入100ml容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度线,盖好瓶塞,反复摇匀
④用100ml量筒量取40ml 5mol/L NaOH溶液,倒入250ml烧杯中,再用同一量筒取60ml蒸馏水,不断搅拌下,慢慢倒入烧杯中
(2)有下列八种物质 ①NH4Cl ②NaOH ③FeCl3④NaHCO3⑤Al ⑥CH3COOH ⑦盐酸 ⑧H2CO3
(A)属于强电解质的是(填序号)
(B)既与盐酸反应又与氢氧化钠反应的是(填序号)
(C)将③的饱和溶液滴入沸水中,继续加热可得红褐色液体,此液体不具有的性质是
A.光束通过该液体时形成光亮的“通路”
B.插入电极通过直流电后,有一极附近液体颜色加深
C.向该液体中加入硝酸银溶液,无沉淀产生
D.将该液体加热蒸干、灼烧后,有氧化物生成
(1)某反应体系中的物质有NaOH、Au2O3,Na2S4O6,Au2O,H2O,Na2S2O3。Au2O3为反应物,回答下列部题
| A.NaOH是(反应物、生成物) |
| B.Na2S4O6是(氧化剂、还原剂、氧化产物、还原产物) |
| C.氧化剂和还原剂的物质的量之比是 |
| D.0.25mol Au2O3发生反应,转移电子数是 |
(2)在酸性条件下MnO4-将SO2氧化成SO42-的同时被还原成Mn2+.写出反应的离子方程式并配平:
写出下列反应的离子方程式
(1)过氧化钠与水;
(2)金属铝与稀硫酸溶液;
(3)向Na2CO3与NaHCO3混和溶液加入CaCl2溶液;
(4)Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个离子方程式表示有关生成H2的变化:
(A),
(B)。
有以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11)水溶液 ⑦酒精(C2H5OH)⑧熔化K2SO4⑨纯水。请回答下列问题(用序号):
(1)以上物质中能导电的是__________
(2)以上物质属于电解质的是_____________
(3)以上物质中属于非电解质的是______________