有关FeSO4的转化关系如图所示(部分物质已略去)。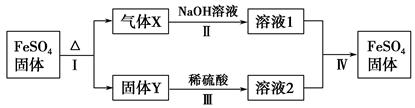
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是(填化学式) 。
(2)反应Ⅰ的反应类型属于(填序号) 。
a.分解反应 b.复分解反应
c.置换反应 d.化合反应
e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是 。
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是 。
(1)某烯烃,经与氢气加成反应可得到结构简式为
的烷烃,则此烯烃可能的结构简式是:___________、___________、___________。
(2)有A、B、C、D、E 5种烃,各取0.01 mol充分燃烧后,B、C、E所产生的二氧化碳均为448 mL(标准状况);A或D燃烧所得的二氧化碳都是前者的3倍。在镍催化剂的作用下,A、B、C都能和氢气发生加成反应,其中A 可以转化为D,B可以转变为C或E,C可以转变为E;B或C都能使高锰酸钾酸性溶液褪色,而A、D、E无此性质;在铁屑存在时A与溴发生取代反应。
①写出烃的结构简式:B是___________, C是___________,D是___________, E是___________。
②写出A与溴反应方程式______________________________
硅是重要的无机非金属材料,工业上从硅的氧化物制取硅单质的主要反应为
SiO2 + 2C Si + 2CO↑。其中,氧化剂是 (填化学式),被氧化的物质是 (填化学式),若反应中消耗了2 mol C,则转移的电子为 mol 。
Si + 2CO↑。其中,氧化剂是 (填化学式),被氧化的物质是 (填化学式),若反应中消耗了2 mol C,则转移的电子为 mol 。
将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况下)。
(1)写出上述过程中,有关反应的离子方程式______________、_____________。
(2)完成该反应至少需要量取10mol/L的浓硝酸__________mL。
(3)混合气体中NO2的体积为__________L,NO的体积为__________L(均为标准状况下)。
(4)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2使其充分反应,若要使溶液恰好充满容器,则理论上需要参加反应的O2的物质的量为____________mol。
按要求书写相关反应的化学方程式:
(1)硫在氧气中燃烧______________________。
(2)在汽车的排气管上装一个催化转化装置,可以治理汽车尾气中的NO和CO,其原理是________
(3)氨的催化氧化________________________。
(4)制取漂白粉__________________________。
(5)工业合成氨__________________________。
将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L的H2SO4溶液中,然后再滴加1 mol/L的NaOH溶液。请回答:若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化的关系如右图所示。
(1)当V1=140 mL时,则金属粉末中:n(Mg)=________mol,V2=_______ml
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=__________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a ,100 mL 2 mol/L 的H2SO4溶解此混合物后,再加入480 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3满足此条件的a的取值范围是_________。