已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。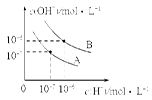
(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是________。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1________α2(填“大于”、“小于”、“等于”或“无法确定”),若二者恰好反应所得溶液的pH<7,原因是__________________。(用离子方程式表示)
(4)在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=________。
在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图10-1)。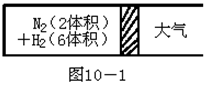
容器中发生如下反应:N2+3H2  2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
⑴保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。那么:①a=1,c=2,则b==。在此情况下,反应起始时将向方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是。
⑵在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是,原因是________________________________ 。
现有可逆反应.2NO2(g) N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
t2:;
t3:;
t4:。
现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的的转化率_________。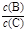 (4)若升高温度,则平衡时B、C的浓度之比将_________。
(4)若升高温度,则平衡时B、C的浓度之比将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量_________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______;而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
(14分,每空2分)已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X 原子的电子层数与它的核外电子总数相同,而Z 原子的最外层电子数是次外层的三倍,Y 与 Z 可以形成两种以上的气态化合物,则
(1)X 是——————————、Y是———————————、Z是———————————(均用元素名称填写)
(2)由Y 和 Z 组成,且Y 和 Z的质量比为7:12的化合物的化学式(分子式)是 _____
(3)由X、Y、Z中的两种元素组成,且与X2Z 分子具有相同电子数的两种离子是 _____————————和 _____—————————(填离子符号)
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4 :2 :3 ,该盐的化学式是 _____——————————————————。—
下表是元素周期表的一部分,回答有关问题。
| ⅠА |
ⅡА |
ⅢА |
ⅣА |
ⅤА |
ⅥА |
ⅦА |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
11 |
12 |
(1)在这些元素中,最活泼的金属元素是(均用元素名称填写)—、最活泼的非金属元素是、最不活泼的元素是
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是(均用化学式填写)、碱性最强的是,呈两性的氢氧化物是,写出三者之间两两相互反应的离子方程式
(3)在这些元素中,原子半径最大的是—、原子半径最小的是(均用元素符号填写)
(4)写出②与④形成化合物的电子式;写出①单质的电子式;