硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校化学兴趣小组的同学以氯化铵和氢氧化钙为主要原料并设计了下列装置来制硝酸(三氧化二铬为催化剂,加热及夹持装置未画出):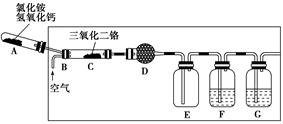
回答下列问题:
(1)实验时,A、C两装置均需加热,应先加热________装置,原因是
________________________________________________________________________。
(2)D装置中应填充的物质是________,该物质的主要作用是____________________。
(3)E装置的作用是__________________,F、G装置中的物质分别是________、________。
(4)若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中画出装置图并注明所用药品的名称)。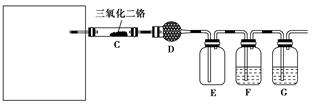
分类方法是研究物质和化学反应的重要方法。
(1)对HCl(盐酸)、H2SO4(硫酸)、HNO3(硝酸)、H3PO4(磷酸)、H2S(氢硫酸)进一步分类时有多种分类角度,请你自定标准进行分类。分类标准是 ,与HCl同属一类的是 。
(2)根据物质的树状分类,PH3的物质类别是 。
A.磷酸盐 B.磷化物 C.氢化物
(3)氧化钙、氢氧化钙分别与盐酸反应的共同点是
,
由此可得出氧化钙属于碱性氧化物。根据上述信息的启示,N2O5与氢氧化钠溶液反应的离子方程式是
。
无机化合物可根据其组成和性质进行分类: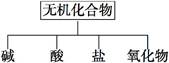
(1)上图所示的物质分类方法名称是 。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
| 物质 类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
①HCl ②____ |
③______ ④Ba(OH)2 |
⑤Na2CO3 ⑥_____ |
⑦CO2 ⑧Na2O2 |
(3)写出⑦转化为⑤的化学方程式
。
(4)实验室制备⑦常用 和反应,检验该气体的方法是 。
小高同学在某食品包装内发现有一包白色颗粒状固体A的小纸袋,上面写着“生石灰干燥剂,请勿食用”。小高同学随手将小纸袋放在窗台上,过一段时间后发现纸袋内的白色颗粒粘在一起成为块状固体B。
(1)A固体的化学名称是 ,干燥物质的原理是
(用化学方程式表示)。
(2)小高同学请你和同学们一起对块状固体B进行探究。
猜想一:块状固体B中除含A外,还可能有 、 (写两种);
猜想二:块状固体B溶于水可能有 现象(填“放热”或“吸热”)。
(3)取块状固体B加入盛有一定量水的试管内,振荡、静置、过滤,得到少量白色固体C。小高同学认为白色固体C中可能有碳酸钙,请写出一种检验其中含有碳酸钙的简单方法 ,你认为白色固体还可能是什么 。
【有机化学基础】
香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省
略):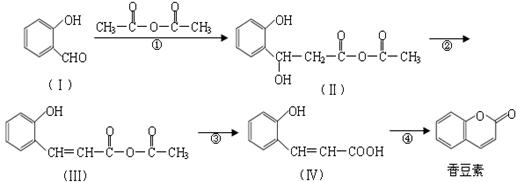
(1)Ⅰ的分子式为_____________;Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为______________。
(2)反应②的反应类型是_____________,反应④的反应类型是_____________。
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为
________。
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,且能够发生酯化反应和银镜反应。Ⅴ的结构简式为_______________(任写一种)。
(5)一定条件下,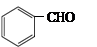 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。
【物质结构与性质】
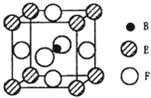
A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是
A 分子中都含有σ键和π键
B 中心原子都sp杂化
C 都是含极性键和非极性键的非极性分子
D 互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为,该晶体的化学式为.若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为。