已知30 ℃时几种盐的溶解度(g/100 g H2O)
| 物质 |
NaCl |
NH4HCO3 |
NaHCO3 |
NH4Cl |
| S/g |
36.3 |
27.0 |
11.1 |
41.1 |
1862年比利时索尔维以CO2、NH3、水为原料制得纯净的Na2CO3,这种制碱法叫索尔维法,其主要操作是:
①在氨化的饱和NaCl溶液中通入CO2制得小苏打;
②再把小苏打焙烧,制得纯碱,而副产物CO2可循环使用;③在析出小苏打的母液中加入生石灰,逸出的NH3循环使用。
1943年我国著名化学家侯德榜先生改进了“索尔维法”,用固体NaCl代替生石灰加入母液中,使NH4Cl晶体析出,生产纯碱和NH4Cl,这便是“侯氏制碱法”。
试回答:
(1)该方法能制得小苏打的原因是
________________________________________________________________________
______________________________。
(2)不能在NaCl溶液中先通入CO2,然后再通NH3制得NaHCO3的原因是
________________________________________________________________________。
(3)在析出小苏打后的母液中加入生石灰发生反应的化学方程式为:
________________________________________________________________________。
(4)“侯氏制碱法”的化学原理中涉及的化学反应类型有________。
A.化合 B.分解
C.置换 D.复分解
写出下列物质的电子式
H2O 1KOH 2
CO2: 3Na2O2: 4
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有下图所示的转化关系,已知C为密度最小的气体。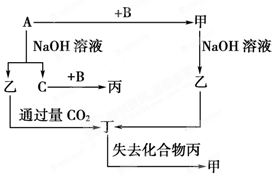
根据图示转化关系回答:
(1)写出下列物质的化学式:B、丙、丁。
(2)组成单质A的元素在周期表中的位置是。
(3)乙与过量CO2反应的离子反应方程式____________________________
(4)A与NaOH溶液反应的化学反应方程式____________________________
已知A、B、C、D四种短周期元素在元素周期表中的相对位置如下图所示,它们的原子序数之和为46。请填空: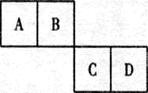
(1)B元素的名称为D元素的原子结构示意 图为。
(2)B有多种氧化物,其中之一是一种无色气体。该气体在空气中会迅速变成红棕色,在一定条件下,4L的该无色气体与3L的氧气相混合,被足量的水完成吸收,且只生成一种B的含氧酸,该含氧酸的化学式为 。
(3)离子半径:D﹣C2﹣(填“>”、“<”、“=”)。还原性:D﹣C2﹣(填“>”、“<”、“=”)。
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。(已知:碳酸不能溶解Al(OH)3沉淀)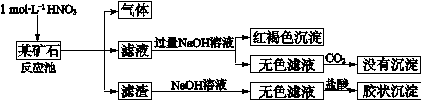
(1)用滤渣制备粗硅的化学反应方程式为
(2)下列说法正确的是
a.酸性:H2CO3>H2SiO3b.结合质子的能力:CO> AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4d.离子半径:O2-<Al3+
(3)滤渣和NaOH溶液反应的离子方程式是
通过现象说明此矿山中不含Al2O3
(4)该矿石和稀HNO3发生氧化还原反应的离子方程式为
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,主要两个目的是,;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg ,理论上至少需要1 molL-1 HNO3的体积为L。
某校学生化学实验小组,为验证Cl2氧化性强于硫和N2,设计了一套实验装置:
(部分夹持装置已略去)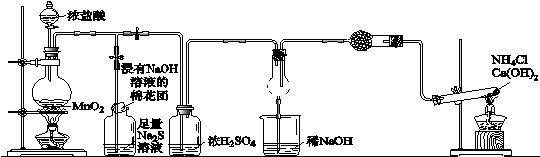
A B C D E
(1)写出A中反应的离子方程式
(2)B中出现黄色浑浊现象,产生此现象的离子方程式
(3)D中干燥管中出现的现象为
产生的NH3过量,则D干燥管发生化学方程式为
(4)有同学认为D中的现象并不能说明Cl2氧化性强于N2,需要在C之前加装洗气装置,请画出
其装置图(并注明盛装试剂)。
(5)证明非金属性Cl > S,用另一种相关事实说明