(1)(3分)防治环境污染,改善生态环境已成为全球的共识。
①空气质量报告的各项指标可以反映出各地空气的质量。下列气体已纳入我国空气质量报告的是 (填字母)。
a.CO2 b.N2 c.NO2
②垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有 (填字母)标志的垃圾筒内。
③工业废水需处理达标后才能排放。下列废水处理的方法合理的是 (填字母)。
a.用中和法除去废水中的酸
b.用混凝剂除去废水中的重金属离子
c.用氯气除去废水中的悬浮物
(2)酸雨是指pH___________的降水,大量燃烧含硫煤产生气体随雨水降落到地面,pH随时间变长会有所减小,试用化学方程式解释其原因。


(3)汽车尾气中一氧化氮与一氧化碳催化转化的 化学方程式为 。北京奥运各场馆都提供“直饮水”,前期处理阶段常常加入明矾和ClO2处理水,明矾中的Al2(SO4)3在水中生成带正电的Al(OH)3胶体,发生反应的离子方程式是 ,ClO2的作用是 。
化学方程式为 。北京奥运各场馆都提供“直饮水”,前期处理阶段常常加入明矾和ClO2处理水,明矾中的Al2(SO4)3在水中生成带正电的Al(OH)3胶体,发生反应的离子方程式是 ,ClO2的作用是 。
加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解,碘酸钾的溶解度随温度升高变化不大。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下: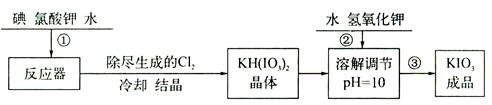
(1)步骤②中氢氧化钾的主要作用是。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过、过滤、洗涤、干燥等步骤。
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
①在滴定过程中,所用的玻璃仪器为 、。
②该实验可以用作指示剂,滴定终点的现象是。
③下列有关该滴定实验的说法不正确的是。
| A.滴定管在使用前必须检查是否漏水并润洗 |
| B.滴定时眼睛注视滴定管内溶液液面变化 |
| C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 |
| D.终点读数时俯视会导致碘的含量偏低 |
④加碘食盐样品中的碘元素含量是g·kg-1(以含w的代数式表示)。
Ⅰ.近年来,地震、洪水、泥石流等各种自然灾害频发,灾害过后,对环境进行消毒杀菌、获取洁净的饮用水都需要大量消毒剂,开发具有广谱、高效、低毒的杀菌、消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质中消毒效率最高的是(填序号)。
A.Cl2 B.H2O2 C.O3 D.ClO2
(2)过氧乙酸(CH3COOOH)是一种多用途的新型液体消毒杀菌剂, 它具有CH3COOH 和H2O2的双重性质。下列物质与过氧乙酸混合,不会使过氧乙酸失效的是(填序号)。
A.FeCl3 B.KMnO4溶液C.稀盐酸 D.NaHCO3溶液
(3)消毒试剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为:HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时,转移的电子数是。
(4)氯氨(NH2Cl)可作杀菌剂,请用化学方程式表示氯氨在水中的杀菌机理:。
Ⅱ.近年来发现许多生物体组织中存在的少量NO有扩张血管、免疫、增强记忆的功能,成为当前生命科学的研究热点。请回答下列问题:
(5)NO在大气层中可发生反应:NO+O2= NO2 + O,NO2 + O ="NO" + O2,从反应最终结果看,NO是一种(填序号);
A.氧化剂
B.还原剂
C.还原产物
D.氧化产物
E.催化剂
(6)将NO转化为无毒气体,可选用NH3在400℃左右并有催化剂存在下把NO还原为氮气和水,写出该反应的化学方程式 ;
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:
| 元素 |
A |
B |
C |
D |
E |
| 性质 或结 构信 息 |
室温下单质呈气态,原子最外层电子数与D相同 |
D3B中阳离子与阴离子的电子层结构相同 |
A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 |
单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 |
E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
试回答以下问题
(1)B在周期表中的位置是,B的氢化物与E的氢化物比较,沸点较高的是(填化学式)。
(2)D3B可与水反应生成2种碱性物质,请写出这一化学方程式。
(3)写出丙的电子式为。并说明丙在空气中漂白的原理(用化学方程式表示)。(请参考下表数据)
| 酸 |
电离常数 |
| HClO |
Ka=3.0×10-8 |
| H2CO3 |
Ka1=4.3×10-7,Ka2=5.6×10-11 |
(4)由A、B、C、D四种元素中的三种元素组成的一种盐丁,其外观与氯化钠相似,丁的水溶液呈碱性。将光亮的铜丝插入丁溶液中,没有现象发生,如用盐酸酸化,反应迅速发生,铜丝缓慢溶解生成深绿色溶液,写出该反应的离子方程式。
(12分)硅孔雀石是一种含铜矿石,含铜形态为CuCO3、Cu(OH)2和CuSiO3∙2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质。以其为原料制取硫酸铜的工艺流程如下图所示: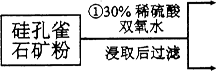
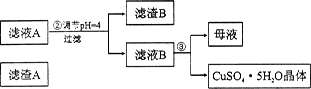
(1)步骤1中先加入足量稀硫酸,再加人双氧水。则双氧水参与该反应的离子方程式是_________________。
(2)步骤②调节溶液pH,可以选用的试剂是________。(填字母编号)
A.A12O3 B.CuO C.CuCO3·Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
则滤液B中含有的阳离子是__________________________。
(4)将滤液B通过_______、________、过滤等操作可得到硫酸铜晶体。
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是______________。取384g CuS在一定条件下和氧气完全反应,若发生2CuS+3O2=2CuO+2SO2和4CuS+5O2=2Cu2O+4SO2两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为bmol。则a=__________。(氧气占空气体积的五分之一)
(8分)二甲醚是一种重要的清洁燃料,有多种合成方法。
方法一:通过CH~OH分子间脱水制得:2CH3OH(g)=CH3OCH3(g)+H2O(g)∆H=-23.5 kJ/mol ①
(1)该反应在恒容密闭的容器中进行,能说明反应达到平衡的是_____。(填字母编号)
A.容器中压强不再变化
B.n(CH3OH):nCH3OCH3):n(H2O)="2:1:1"
C.c(CH3OH)=c(CH3OCH3)=c(H2O)
D.混合气体中各组分浓度不再变化
E.混合气体的平均相对分子质量不再变化
(2)在T℃时该反应的平衡常数K=5,若在此温度下某时刻测定出该反应中各物质的浓度为c(CH3OH)="0.3" mol/L、c(CH3OCH3)="0.6" mol/L、c(H2O)=0.6mol/L,则此时正、逆反应速率的大小是V(正)____V(逆)。(填“>”、“<”或“=”
(3)3H2(g)+3CO(g)= CH3OCH3+3CO2(g) ∆H=-a kJ/mol②
该反应在一定条件下的密闭容器中可达到平衡状态(曲线1),若在t0时刻改变一个条件,曲线I变为曲线Ⅱ,改变的条件是_________。(填字母编号)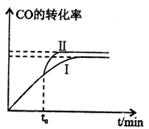
A.升高温度
B.加入催化剂
C.缩小容器体积
D.增加H2的浓度
E.分离出二甲醚
(4)该反应可以分步进行:
4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g) △H3③
CO(g)+H2O(l)=CO2(g)+H2(g) △H4=-bKJ/mol④
H2O(l)=H2O(g) △H5=+44KJ/mol⑤
则反应③的焓变△H3=________KJ/mol(用含a、b的代数式表示)