加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解,碘酸钾的溶解度随温度升高变化不大。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下: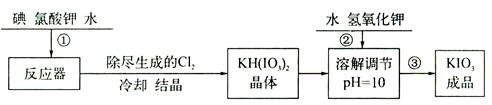
(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
①在滴定过程中,所用的玻璃仪器为 、 。
②该实验可以用 作指示剂,滴定终点的现象是 。
③下列有关该滴定实验的说法不正确的是 。
| A.滴定管在使用前必须检查是否漏水并润洗 |
| B.滴定时眼睛注视滴定管内溶液液面变化 |
| C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 |
| D.终点读数时俯视会导致碘的含量偏低 |
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。
在一个盛有催化剂容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2+3H2⇌2NH3已知加入1 mol N2、4 mol H2时,达到平衡后生成a mol NH3(见表中已知项),在相同温度和压强下保持平衡后各组分体积分数不变,对下列编号①~③的状态,填写表中空白。
| 已知编号 |
始态的物质的量(mol) |
平衡时NH3的 物质的量(mol) |
||
| N2 |
H2 |
NH3 |
||
| 已知 |
1 |
4 |
0 |
a |
| ① |
1 |
0.5a |
||
| ② |
1.5 |
6 |
0 |
|
| ③ |
m |
n( n≥4m) |
如下图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时A、B的体积均为a L,在相同温度和有催化剂条件下,两容器中各自发生反应:
X(g)+Y(g) ⇌2Z(g)+W(g)(正反应为放热反应)达到平衡时A容器的体积为1.2a L。
(1) A中X的转化率αA=
(2) A、B中X的转化率αA αB(填 >、< 或 = )
(3)打开K,一段时间又达到平衡时A的体积为L(连通管中气体体积忽略不计)
(4)在(3)达到平衡后,同时等幅升高A、B的温度,达到新平衡后,A的体积(填变大、变小或不变)
甲醇(CH3OH)的用途广泛,摩托罗拉公司也开发出一种由甲醇、氧气以及强碱做电解质溶液的新型手机电池,容量达氢镍电池或锂电池的10倍,可连续使用一个月才充一次电.请完成下列与甲醇有关的问题.
(1)工业上用3克氢气与二氧化碳反应生成气态甲醇和水蒸气,放出24.5千焦的热量。
①请写出该反应的热化学反应方程式:利用该反应,在温度和容积相同的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
②从反应开始到达到平衡时,A中用CO2来表示的平均反应速率为。
③A中达到平衡时CO2的转化率为, B中a=。
(2)某同学设计了一个甲醇燃料电池,其装置如图:
①写出图中通入甲醇这一极的电极反应式。
②反应一段时间后,正极附近的碱性(增强。减弱不变)
(5分)(1)在一密闭容器中充入1molNO2,建立如下平衡:2NO2  N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为____。
N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为____。
(2)汽车尾气中的主要污染物有CO、NOx,CO分析仪是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是。
| A.负极的电极反应式为:CO+O2—―2e-=CO2 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,说明汽车尾气中CO的含量越高 |
(3)阿波罗宇宙飞船上使用的是氢氧燃料电池,试回答下列问题:
①若电解质溶液为KOH溶液,构成燃料电池,则负极反应式为________________,
②如把KOH改为稀H2SO4作电解质,则正极反应式为________________,
③如把H2改为甲烷,KOH作电解质,则负极反应式为
(12分)(1)“嫦娥一号”登月成功,实现了中国人“奔月”的梦想.“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点是相同质量时,氢气放出的热量多,产物为水无污染。
已知:H2(g)+O2(g)=H2O(l) ΔH=-285.8 kJ/mol ; H2(g)=H2(l) ΔH=-0.92 kJ/mol
O2(g)=O2(l) ΔH=-6.84 kJ/mol ; H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
请写出液氢和液氧生成气态水的热化学方程式:_______________________________.
(2)已知:①NH3(g)+HCl(g)===NH4Cl(s)ΔH=-176 kJ/mol
②NH3(g)+H2O(l)===NH3·H2O(aq)ΔH=-35.1 kJ/mol
③HCl(g)===HCl(aq) ΔH= -72.3 kJ/mol
④NH3·H2O(aq)+HCl(aq)===NH4Cl(aq)+H2O(l)ΔH=-52.3 kJ/mol
则NH4Cl(s)===NH4Cl(aq)的ΔH=______
(3)分别取40 mL的0.50 mol/L盐酸与0.55 mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
① 理论上稀强酸、稀强碱反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式__
② 假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容
c=4.18 J/(g·℃).为了计算中和热,实验时还需测量的数据有(填序号)__________;
| A.反应前盐酸溶液的温度 | B.反应前盐酸溶液的质量 |
| C.反应前氢氧化钠溶液的温度 | D.反应前氢氧化钠溶液的质量 |
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
③ 某学生实验记录数据如下:
| 实验 序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
氢氧化钠 |
混合溶液 |
|
| 1 |
20.0 |
20.1 |
23.2 |
| 2 |
20.2 |
20.4 |
23.4 |
| 3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=____________;
④假定该学生的操作完全同上,实验中改用100 mL 0.5 mol/L盐酸跟100 mL 0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”).