本题为《化学反应原理(选修4)》模块选做题,每空2分,共20分。
(1)氢气是一种新型的绿色能源,又是一种重要的化工原料。
①氢气燃烧热值高。实验测得,在常温常压下,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量。则表示H2燃烧热的热化学方程式是( )
A.H2(g) +1/2 O2(g)=H2O(g) ΔH =+285.8 kJ/mol
B.H2(g) +1/2 O2(g)=H2O(l) ΔH =-285.8 kJ/mol
C.H2(g) +1/2 O2(g)=H2O(l) ΔH =+285.8 kJ/mol
D.H2 +1/2 O2 =H2O ΔH =-285.8 kJ/mol
②氢氧燃料电池能量转化率高,具有广阔的发展前景。氢氧燃料电池中,发生还原反应的物质是 (填“氢气”或“氧气”)。
③氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
反应达到平衡后,升高温度则反应速率 (填“增大”或“减小”);平衡将向 (填“正反应方向”或“逆反应方向”)移动。
(2)锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为Zn+Ag2O=ZnO+2Ag。请回答下列问题:
①该电池的负极材料是 ;电池工作时,阳离子向 (填“正极”或“负极”)移动;
②电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原氧化锌来制取,该反应的化学方程式为ZnO+C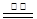 Zn+CO↑,此法属 (填选项字母代号)。
Zn+CO↑,此法属 (填选项字母代号)。
A.电解法 B.热还原法 C.热分解法
(3)今有常温下两种溶液:(A)0.1mol/L的NaCl溶液 (B)0.1mol/LNH4Cl溶液
①溶液(A)的pH 7(填“>”、“<”或“=”);
②溶液(B)呈 性(填“酸”、“碱”或“中”),升高温度可以 (填“促进”或“抑制”)NH4Cl的水解。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
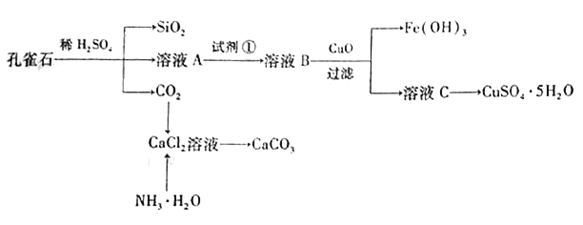
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为(填代号)。
a.KMnO4b.(NH4) 2S c.H2O2d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)(填化学式),若实验过程中有氨气逸出,应选用下列装置回收(填代号)。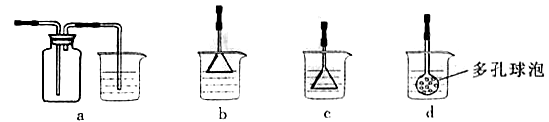
 (4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应,直到,用KMnO4标准溶液滴定时应选用滴定管(填“酸式”或“碱式”)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应,直到,用KMnO4标准溶液滴定时应选用滴定管(填“酸式”或“碱式”)。

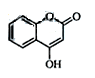
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:


 (1)A与银氨溶液反应有银镜生成,则A的结构简式是。
(1)A与银氨溶液反应有银镜生成,则A的结构简式是。 (2)B→C的反应类型是。
(2)B→C的反应类型是。 (3)E的结构简式是
(3)E的结构简式是 (4)写出F和过量NaOH溶液共热时反应的化学方程式
(4)写出F和过量NaOH溶液共热时反应的化学方程式
 (5)下列关于G的说法正确的是。
(5)下列关于G的说法正确的是。 a.能与溴单质反应 b.能与金属钠反应
a.能与溴单质反应 b.能与金属钠反应 c.1molG最多能和3mol氢气反应d..分子式是C9H6O3
c.1molG最多能和3mol氢气反应d..分子式是C9H6O3
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等,请回答下列问题:

 (1)T的原子结构示意图为
(1)T的原子结构示意图为 (2)元素的非金属性为(原子的得电子能力):Q ______ W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q ______ W(填“强于”或“弱于”)。 (3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是。 (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是 (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。
又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的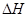 =(注:题中所涉单质均为最稳定单质)。
=(注:题中所涉单质均为最稳定单质)。
(14分)下图所涉及的物质均为中学化学中的常见物质,其中A、C、G是中学化学常见单质,其中A、C是金属,G是气体,B是常见液体,它们存在如下转化关系,反应中部分反应物及次要产物均已略去。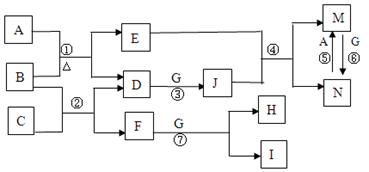
(1)①→⑦中属于氧化还原反应的有______个,④的离子方程式是___________________
(2)实验室中常用反应⑦处理多余G,理论上处理标准状况下6.72L气体G,至少需要5mol/LNaOH溶液体积________,实验室中制取G的离子方程式______________________
(3)向M的溶液中加过量的氨水,写出对应离子方程式_________________________,露置,产物的颜色迅速变化,对应化学方程式是______________________________________
(4)图中有信息能表明A、C的活动性不同,用文字说明_______________________
(12分)钠及其化合物是中学化学常见物质
(1)含氯化钠0.9%的水称为生理盐水,因为它与血浆有相同的渗透压,若将生理盐水的密度视为1g/cm3,则生理盐水的物质的量浓度为_______________(保留两位有效数字)
缺钾患者补钾,可以在食用盐中加入一定比例的钾盐,怎样判断食用的食盐中是否添加了钾盐___________________________________
(2)工业纯碱常混有小苏打,现有二者的混合固体7.0g,加热至质量不变为止,固体变为6.38g,则该工业纯碱的纯度为____,纯碱在工业上有重要的用途,如制玻璃,制玻璃的原料除纯碱外,还需_____________________
(3)在120℃时,将12.4 g CO2和H2O(g)的混合气体缓缓通入过量的过氧化钠固体中,充分反应后,固体的质量增加6g。
①产生氧气在标准状况下的体积是_________;
②原混合气体中CO2的质量是_________;